Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 623 questões
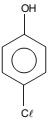
Massa molar = 128,5 g/mol
O número de moléculas existente em 0,257 mg desse corante é: Dado: Constante de Avogadro = 6,0 × 1023 mol−1
CO(g) + H2(g) → H3 COH(g)
Nesta equação
2 ZnS + 3 O2 → 2 ZnO + SO2
ZnO + CO → Zn + CO2
Supondo que as duas etapas tenham rendimento total e que os demais reagentes estejam em quantidade suficiente, a partir de 8,5 mols de sulfeto de zinco a massa aproximada de zinco obtida, em gramas, será
Dados:
Zn - 65 u
S - 32 u
O - 16 u
N2 H4(g) + 2 H2 O2(l) → N2(g) + 4 H2O(g) ΔH = - 644,0 kJ
Com excesso de peróxido de hidrogênio e supondo 100% o rendimento da reação, é possível determinar a massa de hidrazina que, ao ser consumida, produzirá energia equivalente a 2.576 kJ. Esse valor, em gramas, é
Dados:
N - 14 u
H - 1 u
O - 16 u
No ano de 2014, o Estado de São Paulo vive uma das maiores crises hídricas de sua história. A fim de elevar o nível de água de seus reservatórios, a Companhia de Saneamento Básico do Estado de São Paulo (Sabesp) contratou a empresa ModClima para promover a indução de chuvas artificiais. A técnica de indução adotada, chamada de bombardeamento de nuvens ou semeadura ou, ainda, nucleação artificial, consiste no lançamento em nuvens de substâncias aglutinadoras que ajudam a formar gotas de água.
(http://exame.abril.com.br. Adaptado.)
Para a produção de chuva artificial, um avião adaptado pulveriza gotículas de água no interior das nuvens. As gotículas pulverizadas servem de pontos de nucleação do vapor de água contido nas nuvens, aumentando seu volume e massa, até formarem gotas maiores que, em condições meteorológicas favoráveis, podem se precipitar sob a forma de chuva.
Segundo dados da empresa ModClima, dependendo das condições meteorológicas, com 1 L de água lançada em determinada nuvem é possível produzir o volume equivalente a 50 caminhões-pipa de água precipitada na forma de chuva. Sabendo que um caminhão-pipa tem capacidade de 10 m3 , a quantidade de chuva formada a partir de 300 L de água lançada e a força intermolecular envolvida na formação das gotas de chuva são, respectivamente,
Dados de massas molares em g mol-1 : C=12; N=14 e O=16.
Dados: Equação da reação: ½ N2 + O2 → NO2
Massas molares em g mol-1: N2=28 , O2=32 e NO2= 46
C3H8 + 5O2 ? 3CO2 + 4H2O
Admitindo que 30 L, medidos em CNTP (273,15 K e 1 atm), tenham sido queimados na presença de um determinado volume de ar cuja porcentagem de oxigênio é igual a 20% do volume, também medidos em CNTP, assinale o volume de ar necessário para promover a combustão completa do propano.
BaCl2 (s) + Na2 SO4 (aq) → BaSO4 (s) + 2NaCl(aq)
Massas Molares (g.mol -1 )
BaCl2= 208
Na2SO4 = 142
BaSO4 = 233
NaCl = 58,5
Se 5,2 g de BaCl2 são misturados com 5,0 g de Na2SO4, a massa aproximada de BaSO4 obtida, em gramas, será de
BaCl2(s) + Na2SO4(aq) → BaSO4(s) + 2NaCl(aq)
Se 5,2 g de BaCl2 são misturados com 5,0 g de Na2SO4, a massa aproximada de BaSO4 obtida, em gramas, será de
Massas Molares (g.mol-1 )
BaCl2 = 208
Na2 SO4 = 142
BaSO4 = 233
NaCl = 58,5
Obrigatório desde 1997, o componente reduz as emissões
provenientes da queima de combustível
Na época de frio, a qualidade do ar tende a piorar e, para não tornar a situação ainda mais crítica, é preciso atenção ao catalisador do veículo. A peça pode transformar mais de 90% dos gases tóxicos em derivados menos poluentes. [...]
O principal indício de problemas no catalisador é a perda de potência. “Combustível adulterado provoca a ineficiência da reação química que faz a catálise, o que afeta o rendimento", explica o diretor Associação de Engenharia Automotiva (AEA), Alfredo Castelli.
A cor da fumaça que sai pelo escapamento não está relacionada a defeitos na peça. Nesse caso, indica que há algo de errado com o motor.
Thais Villaça
O Estado de São Paulo, 28.05.14
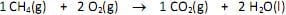
Nessas condições, na queima de 32 mg de metano, será lançada, pelo escapamento do veículo, uma massa de gás carbônico igual a
Dados: H = 1, C = 12, O = 16
RS não deve chegar à costa Catarinense
Mancha se alastrou a uma área equivalente
a 100 campos de futebol
O Litoral catarinense não deve ser afetado com o derramamento de óleo que aconteceu na última
quinta-feira, em Tramandaí (RS), de acordo com o Instituto Nacional do Meio Ambiente (Ibama). Foram cerca de 1,2 mil litros de óleo que caíram no mar, próximo a Tramandaí, no Litoral Norte do Rio Grande do Sul. [...]
A mancha de óleo se alastrou pelo mar e chegou a ocupar uma área equivalente a 100 campos
de futebol. [...] O volume estimado de óleo derramado é de 1,2 m³.
Diário Catarinense, 27.01.2012. Texto adaptado.
Disponível em: http://diariocatarinense.clicrbs.com.br/sc/geral/n...
ento-de-oleo-no-litoral-norte-do-rs-nao-deve-chegar-a-costa-catarinense- 3645427.html
Acesso em 04.07.2014

CaC2 (s) + 2 H2 O ( l ) ? C2 H2 (g) + Ca(OH) 2 (s)

Desde a década de 70, não há comercialização do minério bruto ou do concentrado de nióbio (pirocloro) no mercado interno ou externo. O metal é vendido, sobretudo, na forma da liga ferro-nióbio (FeNb STD, com 66% de teor de nióbio e 30% de ferro), obtida a partir de diversas etapas de processamento. Segundo o governo, as exportações de ferro-liga de nióbio atingiram em 2012 aproximadamente 71 mil toneladas, no valor de US$ 1,8 bilhão.
(http://g1.globo.com. Adaptado.)
Na 9,75% Ca 5,66% Nb 52,51% H 0,21% O 30,52% F 1,34%
Considerando que não haja perdas, é correto afirmar que a massa de pirocloro necessária para obter 1,0 t da liga FeNb STD é, em t, aproximadamente,
A carne de panela é um prato muito apreciado da culinária tradicional, mas em geral é bastante gorduroso, o que o torna inconveniente para muitas pessoas. Para obter uma carne de panela saborosa e com pouca gordura, uma possibilidade é cozinhá-la normalmente, com bastante molho, e deixá-la esfriar; depois, levar à geladeira. Devido a sua ________, a gordura forma placas sólidas por cima do molho, podendo ser facilmente removida. Depois, é só aquecer novamente e tem-se uma carne de panela saborosa e pouco gorda. Esse método é bom para retirar a gordura e o colesterol (sempre presente na gordura animal), mas há uma desvantagem. É que muitos nutrientes são constituídos de moléculas de baixa polaridade, dissolvendo-se preferencialmente em _______. Por isso, são perdidos na remoção das placas, o que poderia levar, por exemplo, à perda do _________.
Os termos que completam corretamente as lacunas são:
Uma das formas mais comuns de preparar medicamentos homeopáticos é por diluições conhecidas como centesimais hahnemannianas (CH). Nelas, o farmacêutico começa com um determinado material ou solução e o dilui a um centésimo da concentração inicial. A solução assim produzida será diluída novamente a um centésimo do que era. Desse modo, são feitas diluições sucessivas até chegar ao número prescrito na receita do médico. Assim, se um medicamento é 30 CH, isso significa que foi submetido a 30 diluições centesimais sucessivas. O medicamento homeopático acidum hydrochloricum, por exemplo, é preparado a partir de uma solução aquosa de ácido clorídrico. Tipicamente, o acidum hydrochloricum é preparado em diluições entre 5 e 30 CH.
Considerando que uma solução 1 mol/L de ácido clorídrico é diluída até certo número de CH, é correto afirmar que
A água de coco é considerada uma bebida muito saudável e indicada para reposição de íons após atividades físicas intensas. Em especial, é uma rica fonte de potássio, que contribui para evitar cãibras. Além disso, a água de coco contém açúcares, que fornecem energia para o organismo. Essa bebida não contém quantidades significativas de proteínas e gorduras. Em uma amostra de água de coco de 200 g (aproximadamente um copo), foram encontradas as seguintes quantidades:
Açúcares 8,0 g
Cálcio 40 mg
Sódio 40 mg
Potássio 156 mg
Magnésio 12 mg
Com base nessas informações, é correto afirmar que a água de coco
Dados: Densidade do PET = 1,3 g cm-3 . Considere que no reaproveitamento do PET não ocorre perda de massa, e que o volume externo da garrafa é de 600 mL.
C8H18 (L) + 25/2 O2(g) ➡ 8CO2(g) + 9H2O(L) Δ H0 = -5471KJ
Nestas condições, é CORRETO afirmar que a razão entre as energias gastas em um ano, nessa jornada, pelo automóvel e o estudante na bicicleta, é aproximadamente