Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 623 questões
Considere: M(Cu) = 63,5 g mol-1
M(S) = 32 g mol-1
Considere: R = 0,082 atm L mol-1 K-1
M(O2) = 32 g mol-1
O metanol é um álcool utilizado como combustível em alguns tipos de competição automotiva, por exemplo, na Fórmula Indy. A queima completa (ver reação termoquímica abaixo) de 1 L de metanol (densidade 0,80 g mL-1 ) produz energia na forma de calor (em kJ) e CO2 (em gramas) nas seguintes quantidades respectivamente:
2 CH3 OH(l) + 3 O2(g) → 4 H2 O(l) + 2 CO2(g) ; ∆H = 1453 kJ
Considere: M(CH3
OH) = 32 g mol-1
M(CO2
) = 44 g mol-1
A decomposição de uma amostra de carbonato de cálcio consumiu 266 kJ. A partir desse resultado e da equação termoquímica abaixo, conclui-se que:
CaCO3(s) → CaO(s) + CO2(g); ΔH = +133 kJ mol-1
A reação do iodato de potássio com bissulfito de sódio, em meio aquoso pode ser representada na sua forma iônica, sem os íons espectadores, como segue:
IO3-(aq) + HSO3-(aq) → I-(aq) + SO42-(aq) + H+(aq)
No balanço de massa e no balanço de carga com os menores coeficientes inteiros, a relação entre as quantidades, em mol, da espécie oxidante e da espécie redutora é de:
O sulfeto de ferro pode ser usado como matéria prima para produção de ácido sulfúrico como indicado na reação.
4 FeS + 9 O2 + 4 H2O → 2 Fe2O3 + 4 H2SO4
Numa reação completa e com FeS como reagente limitante, a massa desse sulfeto metálico que mais se aproxima da necessária para produzir 10 mol de H2SO4 é:
Soluções aquosas de ácido clorídrico, HCl (aq), e de ácido acético, H3CCOOH (aq), ambas de concentração 0,10 mol/L, apresentam valores de pH iguais a 1,0 e 2,9, respectivamente.
Em experimentos separados, volumes iguais de cada uma dessas soluções foram titulados com uma solução aquosa de hidróxido de sódio, NaOH (aq), de concentração adequada. Nessas titulações, a solução de NaOH foi adicionada lentamente ao recipiente contendo a solução ácida, até reação completa. Sejam V1 o volume da solução de NaOH para reação completa com a solução de HCl e V2 o volume da solução de NaOH para reação completa com a solução de H3CCOOH. A relação entre V1 e V2 é
Uma estudante de Química realizou o seguinte experimento: pesou um tubo de ensaio vazio, colocou nele um pouco de NaHCO3 (s) e pesou novamente. Em seguida,adicionou ao tubo de ensaio excesso de solução aquosa de HCl, o que provocou a reação química representada por
NaHCO3(S) + HCl(aq) → NaCl(aq) + CO2(g) +H2O(l)
Após a reação ter-se completado, a estudante aqueceu o sistema cuidadosamente, até que restasse apenas um sólido seco no tubo de ensaio. Deixou o sistema resfriar até a temperatura ambiente e o pesou novamente. A estudante anotou os resultados desse experimento em seu caderno, juntamente com dados obtidos consultando um manual de Química:

A estudante desejava determinar a massa de
I. HCl que não reagiu;
II. NaCl que se formou;
III. CO2 que se formou.
Considerando as anotações feitas pela estudante, é possível
determinar a massa de
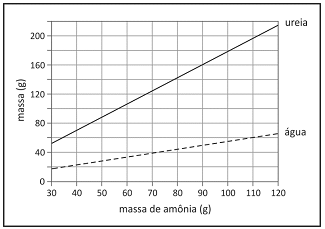
Amônia e gás carbônico podem reagir formando ureia e água. O gráfico ao lado mostra as massas de ureia e de água que são produzidas em função da massa de amônia, considerando as reações completas.
A partir dos dados do gráfico e dispondo-se de 270 g de amônia, a massa aproximada, em gramas, de gás carbônico minimamente necessária para reação completa com essa quantidade de amônia é
Na notícia “Nova Iorque planeja liderança em reciclagem”, do site da Science American Brasil, há importantes referências ao sofisticado sistema de separação dos materiais presentes no lixo dessa cidade.
“A primeira coisa que a usina do Brooklyn fará é rasgar e remover as sacolas plásticas que tantos nova-iorquinos usam para empacotar seus recicláveis. O vidro será moído, separado e transportado pelo Porto de Nova York até Nova Jersey, onde ele passará por uma nova máquina de raios-x para ser novamente separado; contaminantes como boro e vidro com chumbo também serão removidos. De volta ao Brooklyn, outros recicláveis passam por uma correia transportadora enquanto ímãs extraem metais ferrosos.
O plástico e o alumínio restantes são passados por correntes de Foucault, que extraem o alumínio.”
TWEED, Katherine. Nova Iorque planeja liderança em reciclagem. Scientifi c American Brasil.
(http://www2.uol.com.br/sciam/noticias/nova_iorque_ planeja_lideranca_em_reciclagem.html).
Sobre os materiais citados no texto, é correto afirmar
que
Enquanto estudava a natureza e as propriedades dos gases, um estudante anotou em seu caderno as seguintes observações sobre o comportamento de 1 litro de hidrogênio e 1 litro de argônio, armazenados na forma gasosa à mesma temperatura e pressão:
I. Têm a mesma massa.
II. Comportam-se como gases ideais.
III. Têm o mesmo número de átomos.
IV. Têm o mesmo número de mols.
É correto o que o estudante anotou em
A cal, muito utilizada na construção civil, é obtida na indústria a partir da reação de decomposição do calcário, representada pela equação:
CaCO3(s) 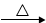 CaO(s) + CO2(g)
CaO(s) + CO2(g)
A fonte de calor para essa decomposição pode ser o gás natural,cuja reação de combustão é representada por:
CH4(g) + 2O2(g) → 2H2O(l) + CO2(g)
Considerando as massas molares:
H = 1,0 g·mol–1 , C = 12,0 g·mol–1 ,
O = 16,0 g·mol–1 , Ca = 40,0 g·mol–1 ,
a massa de gás carbônico lançada na atmosfera quando são produzidos
560 kg de cal, a partir da decomposição térmica do calcário,
utilizando o gás natural como fonte de energia, é:
TEXTO 8
CAPÍTULO XVIII
Rubião e o cachorro, entrando em casa, sentiram, ouviram a pessoa e as vozes do finado amigo. Enquanto o cachorro farejava por toda a parte, Rubião foi sentar-se na cadeira, onde estivera quando Quincas Borba referiu a morte da avó com explicações científicas. A memória dele recompôs, ainda que de embrulho e esgarçadamente, os argumentos do filósofo. Pela primeira vez, atentou bem na alegoria das tribos famintas e compreendeu a conclusão: “Ao vencedor, as batatas!”. Ouviu distintamente a voz roufenha do finado expor a situação das tribos, a luta e a razão da luta, o extermínio de uma e a vitória da outra, e murmurou baixinho:
— Ao vencedor, as batatas!
Tão simples! tão claro! Olhou para as calças de brim surrado e o rodaque cerzido, e notou que até há pouco fora, por assim dizer, um exterminado, uma bolha; mas que ora não, era um vencedor. Não havia dúvida; as batatas fizeram-se para a tribo que elimina a outra a fim de transpor a montanha e ir às batatas do outro lado. Justamente o seu caso. Ia descer de Barbacena para arrancar e comer as batatas da capital. Cumpria-lhe ser duro e implacável, era poderoso e forte. E levantando-se de golpe, alvoroçado, ergueu os braços exclamando:
— Ao vencedor, as batatas!
Gostava da fórmula, achava-a engenhosa, compendiosa e eloquente, além de verdadeira e profunda. Ideou as batatas em suas várias formas, classificou-as pelo sabor, pelo aspecto, pelo poder nutritivo, fartou- -se antemão do banquete da vida. Era tempo de acabar com as raízes pobres e secas, que apenas enganavam o estômago, triste comida de longos anos; agora o farto, o sólido, o perpétuo, comer até morrer, e morrer em colchas de seda, que é melhor que trapos. E voltava à afirmação de ser duro e implacável, e à fórmula da alegoria. Chegou a compor de cabeça um sinete para seu uso, com este lema: AO VENCEDOR AS BATATAS.
Esqueceu o projeto do sinete; mas a fórmula viveu no espírito de Rubião, por alguns dias: — Ao vencedor as batatas! Não a compreenderia antes do testamento; ao contrário, vimos que a achou obscura e sem explicação. Tão certo é que a paisagem depende do ponto de vista, e que o melhor modo de apreciar o chicote é ter-lhe o cabo na mão.
(ASSIS, Machado de. Quincas Borba. São Paulo: Ática,
2011. p. 38-39.)
O brim é um tecido composto principalmente de algodão. É comumente tingido de índigo (colorante azul) que tem uma produção anual de 50 mil toneladas. A maioria dessa produção (95%) é destinada à indústria têxtil. Devido à baixa afinidade do índigo pela fibra de algodão, somente a superfície dos fios fica azul, deixando o núcleo da fibra com coloração branca. Estima-se que cerca de 15% do índigo usado na indústria têxtil é descartado como resíduo. Esse resíduo, quando não tratado corretamente, acaba causando sérios problemas ambientais.
O algodão tem em sua constituição 94% de celulose, cuja fórmula molecular é (C6 H10O5 )n. A celulose é um polissacarídeo formado por um único monômero (a glicose: C6 H12O6 ). Ela pode apresentar uma configuração aberta ou fechada, dependendo do ambiente químico.
Assinale a única alternativa correta com relação ao exposto acima:
De acordo com o texto, para cada hectare de vegetação em fase de crescimento, o volume máximo de CO2, nas CATP, que pode ser retirado da atmosfera, em m3, corresponde a, aproximadamente, Dados: Volume molar de qualquer gás, nas CATP = 25 L . mol-1 Massa molar do CO2 = 44 g . mol−1
(Adaptado Revista Scientific American Brasil, agosto de 2013. p. 13)
A porcentagem, em massa de silício, na sílica é de:
Dado: Massas molares (g . mol−1):
O = 16 Si = 60