Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 622 questões
Em motores de foguetes, ocorre a seguinte reação de hidrazina com peróxido de hidrogênio:
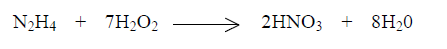
Para a produção de 630,1 gramas de ácido nítrico, são necessários quantos mols de hidrazina (N2H4)?
O biodiesel substitui total ou parcialmente o óleo diesel de petróleo em motores automotivos. O seu consumo contribui para a redução da poluição atmosférica, já que o biodiesel não contém enxofre em sua composição, além de gerar alternativas de empregos em áreas geográficas menos propícias para outras atividades econômicas. Tal combustível é obtido a partir da reação química entre óleos vegetais, como demonstrada na fórmula abaixo, ou gorduras, com um álcool, na presença de um catalisador, produzindo um novo éster (biodiesel) e a glicerina (C3H8O3). Admitindo uma reação entre 319 gramas de óleo de soja (massa molar 638g/mol) e metanol em quantidade suficiente, a massa formada de glicerina (massa molar 92 g/mol), numa reação com 50% de rendimento, é de
C39H74O6 + 3 CH3OH ↔ C3H8O3 + 3 C13H26O2
Sem dúvidas, o maior crescimento do feto ocorre durante o último trimestre de gestação; seu peso quase duplica durante os últimos 2 meses de gestação. Comumente, a mãe não absorve proteínas, cálcio, fosfatos e ferro suficientes pela dieta, durante os últimos meses de gestação para suprir essas necessidades extras do feto. Entretanto, antecipando essas necessidades extras, o corpo da mãe já armazenou essas substâncias – parte na placenta, mas a maioria nos depósitos normais da mulher. Se os elementos nutricionais apropriados não estiverem presentes na dieta da gestante, pode ocorrer uma série de deficiências maternas, especialmente de cálcio, fosfatos, ferro e vitaminas. Por exemplo, o feto precisa de cerca de 375 miligramas de fero para formar seu sangue, e a mãe precisa de outros 600 miligramas para formar seu próprio sangue extra. A reserva normal de ferro não ligado à hemoglobina na mulher, no início da gravidez, geralmente fica em torno de 100 miligramas e quase nunca acima de 700 miligramas. Por isso, sem ferro suficiente na dieta, a gestante muitas vezes desenvolve anemia hipocrômica.
JOHN E. HALL. Tratado de fisiologia médica. 12º ed Rio de Janeiro: Elsevier, 2011.
Na profilaxia e tratamento da anemia hipocrômica, normalmente são utilizados medicamentos à base de Ferro. Num dos mais comuns, o ferro apresenta-se na forma de “ferro aminoácido quelato”, fórmula química C4H8N2O4Fe. Quantos milimols de ferro ao dia um paciente que utilize diariamente a posologia de 265mg do medicamento ingere? (Dados: C = 12,0 g/mol; H = 1,0 g/mol; N = 14,0 g/mol; O = 16,0 g/mol; Fe = 53,0 g/mol)
Da forma semelhante a outros óxidos, o SO2 reage com a água formando o ácido sulfuroso: SO2 (g) + H2O (l) → H2SO3 (aq) H2SO3 (aq) → H+ (aq) + HSO3- (aq)
O SO2 pode ainda sofrer oxidação na atmosfera e formar o trióxido de enxofre (SO3), o qual, por sua vez, em contato com a água da chuva, formará o ácido sulfúrico (H2SO4), que é um ácido forte. SO2 (g) + ½ O2 (g) → SO3 (g) SO3 (g) + H2O (l) → H2SO4 (aq) H2SO4 (aq) → 2H+ (aq) + SO4 2- (aq)
Assumindo que a fórmula química do carvão é C135H96O9NS e que uma usina termelétrica movida a carvão queima cerca de 2,74 x 106 kg de carvão por dia, a quantidade em mols de SO2 despejados na atmosfera durante a queima deste carvão, em um dia normal, é (Dados: S = 32,0 g/mol; C = 12,0 g/mol; H = 1,0 g/mol; O = 16 g/mol; N = 14 g/mol)
