Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 622 questões
Uma amostra de um composto orgânico foi queimada em atmosfera rica em oxigênio de forma a transformar todo o carbono em gás CO2 . Esse gás foi borbulhado em uma solução de hidróxido de bário, onde todo o CO2 foi precipitado na forma de BaCO3 (ver equação). Se 0,106 g de amostra produziu 0,296 g de BaCO3 , a percentagem (valor mais próximo) de carbono na substância é
CO2(g) + Ba2+(aq) → BaCO3(s)
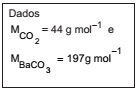
Dados MCO2 = 44 g mol-1 e MBaCO3 197g mol-1

Admita que foram consumidos 252 g de HNO3 para a completa dissolução das medalhas. Nesse caso, a massa, de NaHSO3 , em gramas, necessária para a recuperação de todo o ouro corresponde a: