Questões de Vestibular
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 220 questões
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Os compostos iônicos possuem pontos de fusão e ebulição mais altos que os compostos moleculares.
Tendo como referência as informações precedentes e considerando os conceitos de ligação química, geometria e forças intermoleculares, julgue o item.
Quando átomos se unem por compartilhamento de elétrons, uma ligação iônica se estabelece, denominando-se moléculas os grupos de átomos unidos por meio desse tipo de ligação.
Faça o que se pede no item que é do tipo D.
Explique por que o ligante amônia influencia a geometria molecular do [Co(NH3)6] 2+ e por que o meio básico é essencial para a formação do complexo.
TipoD
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O nitrogênio é mais propenso a formar ligações duplas e triplas que o fósforo, devido ao seu menor raio atômico e à sua maior eletronegatividade.
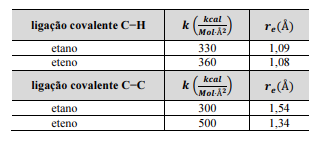
Para a ligação C−H esticada 0,02 Å além da sua distância de equilíbrio, a energia potencial em um eteno será menor que em um etano.

A partir das informações precedentes, julgue o item que se segue.
Para a ligação C−C esticada 0,2 Å além de sua respectiva distâncias de equilíbrio, a força de interação na ligação do eteno é duas vezes mais intensa que na ligação do etano.
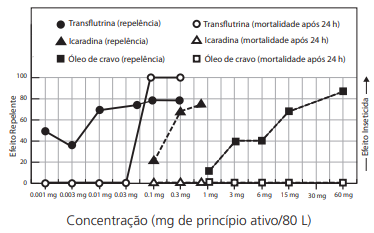
Com base nos resultados experimentais, é correto afirmar que, na faixa considerada,
O Al2O3 é um óxido básico, de caráter iônico, formado pelos íons Al3+ e O2- .
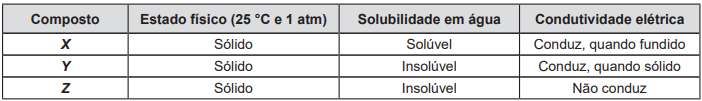
Com base no quadro, a natureza da ligação química mais provável para os compostos X, Y e Z é, respectivamente, _________, _________ e _________.
Tendo como referência as informações precedentes, julgue o item que se segue.
O ânion do composto da siderita tem geometria molecular
tetraédrica.

Considerando o exposto, o elemento mais adequado para ser utilizado no lugar do alumínio de forma a obter os menores custo e densidade possíveis, com a máxima resistência a corrosão possível, é:
Considerando as informações do texto apresentado, julgue o item a seguir.
No NaClO, as ligações entre os elementos sódio, cloro e oxigênio são iônicas.
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

Considere o ciclo para o NaCl na figura a seguir:
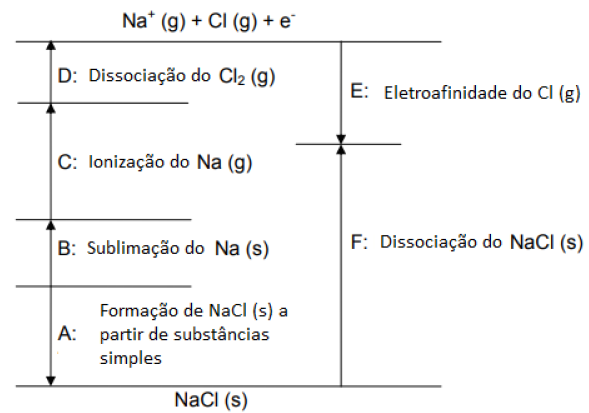
A representação CORRETA de um dos processos que ocorrem nesse ciclo é:
Os vasos são objetos, que estão comumente presentes na decoração dos ambientes de uma casa. Eles podem ser constituídos por vários materiais, a exemplo de vidro, gesso, barro, prata, porcelana etc. Suponha que uma casa contenha dois vasos não plásticos, que chamaremos de A e B, idênticos em aparência, mas fabricados com materiais diferentes. Os vasos são usados para reserva de água aromatizada e, em um acidente, eles caem da prateleira. O vaso A quebra, e o vaso B apenas amassa. (Fonte: FERNANDES, 2011, adaptado)
Que tipos de ligação química estão presentes nas substâncias formam os vasos A e B, respectivamente?
Assinale a alternativa que justifica, do ponto de vista químico, as razões para a informação do vídeo ser equivocada.
