Questões de Vestibular
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 218 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Compostos sólidos formados por ligações iônicas são duros e quebradiços e possuem altos pontos de fusão.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Quanto maior a diferença na eletronegatividade entre os átomos participantes de uma ligação, maior a probabilidade dessa ligação ser do tipo iônica.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
No composto CaCO3, são encontradas ligações do tipo covalente e iônica.
MX (s) ↠ M+(g) + X-(g)
Considere os seguintes compostos: NaF, NaCl, CaF2, CaCl2‚, LiF e LiCl. Com base nas informações, assinale a alternativa correta.
A seguir estão representadas quatro estruturas de substâncias.
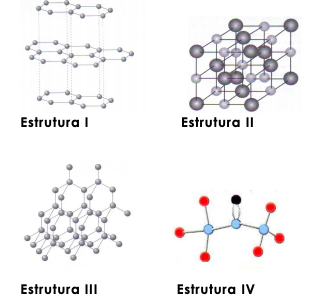
Considerando-se essas estruturas, é correto afirmar:

Desde eras remotas o ser humano extrai da natureza corantes, numa busca incessante pela diversidade de cores. São exemplos, o índigo, extraído da planta Indigofera tinctoria, e a brasileína, da Caesalpinia echinata (pau-brasil), entre muitos outros extraídos de vegetais. No entanto, poucas substâncias de origem animal foram utilizadas como corantes têxteis. Apesar disso, os corantes vermelhos provenientes de insetos, o quermes e a cochinilha, foram muito apreciados. Por exemplo, o Império Romano valorizava-os tanto que era um dos tributos que as nações conquistadas tinham de pagar. O imperador Nero chegou a punir com a morte o uso da púrpura de Tiro, corante obtido a partir de espécies de um molusco do género Murex.
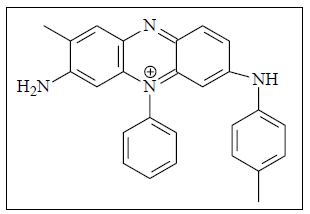
A história mostra que a determinação da estrutura da mauveína não foi fácil de ser alcançada. De modo satisfatório, a estrutura química deste corante só foi conseguida em 1994. De fato existem quatro compostos denominados de mauveína, sendo um deles (mauveína A) apresentado ao lado.
Com base nesta estrutura, pode-se dizer que a mauveína A é um composto


Um disco circular feito de alumínio de alta pureza, com 20,0 cm de raio, espessura de 2,0 mm e massa de 675,0 g, gira em torno de um eixo fixo em seu centro, descrevendo ângulos de 30º a cada 2,0 segundos.
Dados:
Considerando o exposto, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Observe atentamente o quadro a seguir, cujos valores de temperatura de ebulição foram medidos sob pressão de 1,0 atm.

Na indústria química, um dos gases mais utilizados é o cloro. Com relação à estrutura de sua molécula, assinale o que for correto.

Na indústria química, um dos gases mais utilizados é o cloro. Com relação à estrutura de sua molécula, assinale o que for correto.




COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando as afirmações a seguir referentes ao seguinte rol de substâncias: HCl, H2SO4, NaOH, Na2SO4, HCN, CaCl2 e Ca(OH)2, assinale o que for correto.