Questões de Vestibular
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 215 questões
Sobre a informação, assinale a alternativa incorreta.
Considerando-se essas informações sobre os sais hidratados, é correto afirmar.
I. O produto da reação é um composto iônico. II. O átomo de xenônio perde elétron transformando-se em um cátion. III. O número de prótons do núcleo do átomo de xenônio diminui de uma unidade.
É correto o que se afirma em
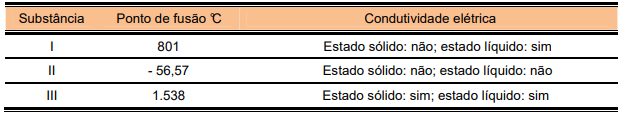
A partir destas informações, pode-se concluir que as substâncias I, II e III, respectivamente, são formadas por ligações:

O bronze utilizado na confecção dos lustres é
A maioria dos elementos da tabela periódica apresenta-se como metais quando cristalizados na sua substância pura. Suas propriedades químicas são alvos tanto da pesquisa quanto da aplicação industrial. Por pertencerem a uma mesma classe, os metais possuem características similares. Sobre as características dos metais, considere as seguintes afirmativas:
1. Metais apresentam alta condutividade térmica e elétrica.
2. Metais possuem altos valores de eletronegatividade.
3. Metais apresentam baixa energia de ionização.
4. Metais reagem espontaneamente com oxigênio.
Assinale a alternativa correta.
I. O cromo é usado para recobrir metais.
II. O 2,2,4-trimetilpentano é usado na constituição da gasolina.
III. O etanol é o principal componente do álcool gel.
São responsáveis pelos estados físicos dessas substâncias, respectivamente,
O cloreto de magnésio (MgCℓ2 ) é um suplemento mineral que pode ser administrado, sob via oral, em humanos, com intuito de regular diversas funções no organismo. Já o captopril, cuja estrutura química está representada a seguir, é muito utilizado no controle da pressão arterial.
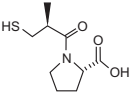
A respeito da ligação carbono-enxofre, observada na molécula do captopril, e da ligação presente no MgCℓ2 , verifica-se que são, respectivamente,
Observe as representações abaixo e assinale a alternativa correta.

Há um tipo de ligação interatômica em que os elétrons das camadas mais externas transitam entre os cátions da rede cristalina. Por essa característica, tal ligação é comparada a um “mar de elétrons”.
“Mar de elétrons” é uma metáfora que se refere ao seguinte tipo de ligação:
De acordo com a teoria das colisões, para ocorrer uma reação química em fase gasosa deve haver colisões entre as moléculas reagentes, com energia suficiente e com orientação adequada.
Considere as seguintes afirmações a respeito da teoria das colisões.
I - O aumento da temperatura aumenta a frequência de colisões e a fração de moléculas com energia suficiente, mas não altera a orientação das moléculas.
II - O aumento da concentração aumenta a frequência das colisões.
III- Uma energia de ativação elevada representa uma grande fração de moléculas com energia suficiente para a reação ocorrer.
Quais estão corretas?
