Questões de Vestibular
Sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 218 questões
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
Um joalheiro bastante experiente lapidou um pedaço de vidro e um diamante do mesmo tamanho, cortando-os em inúmeras facetas e, a seguir, os poliu de forma a ficarem idênticos. Contudo, o vidro não apresenta o mesmo brilho do diamante ao ser incidido pela luz.
Fonte: SOUZA, Líria Alves de. "Brilho do diamante"; Brasil Escola. Disponível em <https://brasilescola.uol.com.br/quimica/brilho-diamante.htm>. Acesso em 20 de maio de 2018. (adaptado)
O vidro, mesmo após todo esse processo, não exibe o mesmo brilho pois o diamante é um sólido
1 N2(g) + 3 H2(g) ⇌ 2 NH3(g) ∆H = –17 kcal/mol
A respeito desse equilíbrio, assinale a afirmativa incorreta.
O MgCO3, chamado popularmente de pó de magnésio, é usado pelos atletas da ginástica artística, sendo aplicado nas mãos antes de iniciar a atividade para eliminar o suor, dando maior firmeza. Sobre esse composto, foram feitas as seguintes afirmações:
I – pertence à função sal.
II – é formado por 3 elementos e 6 átomos.
III – é uma substância simples.
IV – é um composto iônico.
V – o metal, presente em sua fórmula, pertence à família dos metais alcalinos.
Assinale a alternativa CORRETA.
Um joalheiro bastante experiente lapidou um pedaço de vidro e um diamante do mesmo tamanho, cortando-os em inúmeras facetas e, a seguir, os poliu de forma a ficarem idênticos. Contudo, o vidro não apresenta o mesmo brilho do diamante ao ser incidido pela luz.
Fonte: SOUZA, Líria Alves de. "Brilho do diamante"; Brasil Escola. Disponível em . Acesso em 20 de maio de 2018. (adaptado)
O vidro, mesmo após todo esse processo, não exibe o mesmo brilho pois o diamante é um sólido
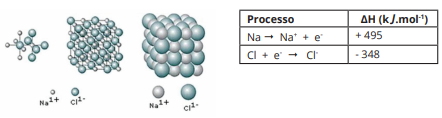
A forma como os átomos se unem influencia as propriedades de metais de espécies iônicas, de moléculas, de agregados iônicos e moleculares, o que põe em evidência a relação entre propriedades físicas e químicas de substâncias com as ligações químicas e a natureza de interações interpartículas.
Considerando-se essas informações sobre a relação entre as propriedades físicas e químicas com as ligações químicas, é correto afirmar:
As propriedades dos compostos químicos são funções das ligações entre os átomos formadores da molécula, da geometria e da polaridade molecular. Com relação aos compostos: CO2, SO2, CH4, NaBr e HF, verifique as proposições abaixo.
I. O CO2 é uma molécula linear e polar.
II. O SO2 é uma molécula angular e polar.
III.O CH4 é uma molécula piramidal e apolar.
IV.O NaBr é um composto iônico.
V. O HF é uma molécula que apresenta pontes de hidrogênio.
São verdadeiras, apenas, as proposições
Texto adaptado de http://sustentabilidade.estadao.com.br/noticias/geral,poluicao-do-arem-sao-paulo-e-duas-vezes-o-limite-da-oms,10000050538 Acesso em 23 de agosto de 2017.
Acerca dos compostos mencionados no fragmento de texto acima, é possível afirmar que:
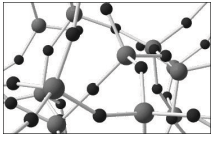 A substância representada por esse modelo
tridimensional pode ser
A substância representada por esse modelo
tridimensional pode ser 



As ligações químicas realizadas entre átomos conferem às subtâncias diferentes propriedades químicas e físicas.
Sobre os tipos de ligações, assinale a alternativa que apresenta, correta e respectivamente, as ligações químicas nas substâncias NaH, FeCℓ3, diamante, Sn (estanho), polietileno e HNO3.

Experiência – Escrever uma mensagem secreta no laboratório
Materiais e Reagentes Necessários
✓ Folha de papel
✓ Pincel fino
✓ Difusor
✓ Solução de fenolftaleína
✓ Solução de hidróxido de sódio 0,1 mol/L ou solução saturada de hidróxido de cálcio
Procedimento Experimental
Utilizando uma solução incolor de fenolftaleína, escreva com um pincel fino uma mensagem numa folha de papel.
A mensagem permanecerá invisível.
Para revelar essa mensagem, borrife a folha de papel com uma solução de hidróxido de sódio ou de cálcio, com o auxílio de um difusor.
A mensagem aparecerá magicamente com a cor vermelha.
Explicação
fenolftaleína é um indicador que fica vermelho na presença de soluções básicas, nesse caso, uma solução de hidróxido de sódio ou de cálcio.
A história do seriado Breaking Bad gira em torno de um professor de Química do ensino médio, com uma esposa grávida e um filho adolescente que sofre de paralisia cerebral. Quando é diagnosticado com câncer, ele abraça uma vida de crimes, produzindo e vendendo metanfetaminas.
O uso de drogas pode desestabilizar totalmente a vida de uma pessoa, gerando consequências devastadoras e permanentes. Muitas vezes, toda a família é afetada.
As metanfetaminas são substâncias relacionadas quimicamente com as anfetaminas e são um potente estimulante que afeta o sistema nervoso central.
(http://tinyurl.com/pffwfe6 Acesso em: 13.06.2014. Adaptado)
Considere os elementos químicos e seus respectivos números atômicos, representados na figura.

(http://tinyurl.com/kun3zgs Acesso em: 30.08.2014.)
Esses elementos podem formar o composto
