Questões de Vestibular
Sobre propriedades coligativas: tonoscopia, ebulioscopia, crioscopia e pressão osmótica. em química
Foram encontradas 91 questões
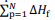 representa o somatório das
entalpias-padrão de formação dos produtos e
representa o somatório das
entalpias-padrão de formação dos produtos e 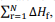 o
somatório das entalpias-padrão de formação dos reagentes.
o
somatório das entalpias-padrão de formação dos reagentes.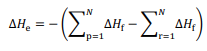
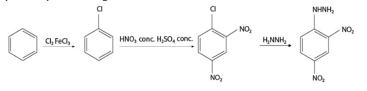
A partir dessas informações e considerando que o volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases se comportem de forma ideal, julgue o item que se segue.
Considerando-se que uma solução aquosa tenha sido preparada dissolvendo-se 246 g de nitrato de ureia (CH5N3O4) em 1 kg de acetonitrila (C2H3N) e sabendo-se que a pressão de vapor da acetonitrila, a 27 °C, é igual a 100 mmHg, é correto deduzir que a pressão máxima da solução preparada à mesma temperatura será inferior a 93 mmHg.

Uma solução de NaOH apresenta pressão de vapor superior à da água pura na mesma temperatura.

DADOS QUE PODEM SER USADOS NESTA PROVA

Nesse sentido, 500mL de uma solução aquosa de manitol (isômero da glicose – C6H12O6) deve ser administrada por um veterinário em um cão que passará por tratamento neurológico, a fim de tentar diminuir a pressão intracraniana, devido à sua ação diurética por osmose. Sabendo que o sangue tem pressão osmótica de 7,6atm, a 38ºC (temperatura corporal do cão), e que a solução injetada deve ser isotônica ao sangue do animal, a concentração da solução de manitol a ser injetada deve ser, em mol.L-1, aproximadamente igual a
1 - Aquecimento da água do mar, seguido de evaporação e condensação do vapor d' água. 2 - Resfriamento da água do mar até formação de gelo, composto essencialmente de água pura. 3 - Passagem da água do mar por uma membrana semipermeável, através da aplicação de uma pressão elevada.
As propriedades coligativas, envolvidas nas técnicas descritas nos itens 1, 2 e 3, podem ser classificadas, respectivamente, como
Está(ão) correta(s) apenas a(s) afirmativa(s)
• Na2 SO4 0,10 mol/L • C6 H12O6 0,30 mol/L • KCl 0,15 mol/L
Comparando essas três soluções, pode-se afirmar que elas têm a mesma
Em relação às mudanças provocadas no líquido, é CORRETO afirmar que haverá
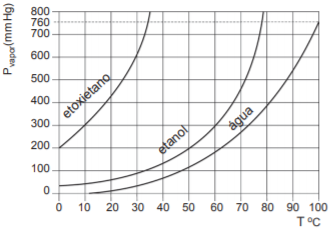
Considerando-se essa informação associada às propriedades físicas dos líquidos puros, é correto afirmar:
Dados: massa molecular da glicose = 180 g.mol-1 e constante ebulioscópica (Ke) da água = 0,52°C.molal-1

Frasco Identificação 1 Solução de HCl 0,1 mol/L 2 Solução de Glicose 0,5 mol/L 3 Solução de MgCl2 0,1 mol/L 4 Solução de KCl 0,2 mol/L 5 Solução de CaCl2 0,2 mol/L
Analisando a descrição dos frascos, o aluno chegou à conclusão de que a ordem crescente de temperatura de congelamento das soluções é:
Um grupo de alunos do curso de Química, ao entrar no laboratório para uma atividade, deparou-se com alguns recipientes não rotulados, embora todos contivessem uma substância líquida e incolor.
Considerando as substâncias, os acadêmicos determinaram as seguintes propriedades para reconhecimento: 1) massa, 2) volume, 3) ponto de ebulição, 4) densidade.
Com base nestas informações, indique quais propriedades possibilitaram aos acadêmicos a identificação das substâncias:
Assinale com V (verdadeiro) ou F (falso) as afirmações abaixo, referentes a compostos inorgânicos.
( ) O fosfato de sódio, embora seja considerado um composto iônico, possui ligações covalentes no íon fosfato.
( ) Compostos iônicos tendem a ter pontos de fusão e ebulição mais elevados do que os compostos moleculares.
( ) BeF2 não obedece à regra do octeto.
A sequência correta de preenchimento dos parênteses, de cima para baixo, é
Observe o gráfico abaixo, referente à pressão de vapor de dois líquidos, A e B, em função da temperatura.
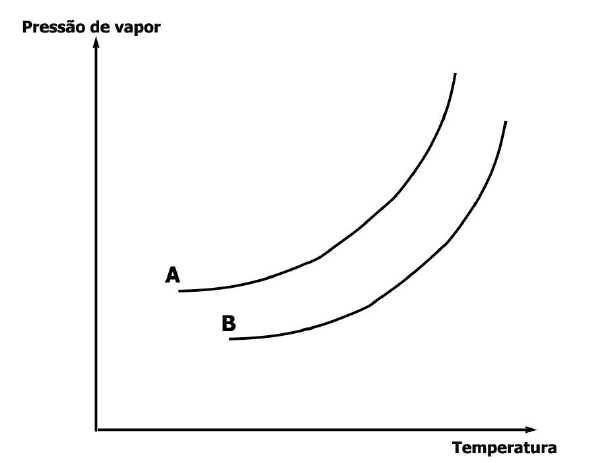
Considere as afirmações abaixo, sobre o gráfico.
I - O líquido B é mais volátil que o líquido A.
II - A temperatura de ebulição de B, a uma dada pressão, será maior que a de A.
III- Um recipiente contendo somente o líquido A em equilíbrio com o seu vapor terá mais moléculas na fase vapor que o mesmo recipiente contendo somente o líquido B em equilíbrio com seu vapor, na mesma temperatura.
Quais estão corretas?
Considere as três soluções aquosas abaixo:
(1) Al(NO3)3 0,10 mol/L (2) FeCl2 0,133 mol/L (3) Na2SO4 0,300 mol/L
Assinale a alternativa que representa as informações corretas acerca das temperaturas de
ebulição das soluções.

