Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Os processos químicos descritos no texto são corretamente representados em:
Dissolveu uma pequena quantidade do sal de cozinha em 300mL de água e introduziu na solução preparada um fio de cobre polido.
Considerando os valores de potencial de redução padrão a seguir:
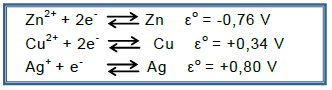
pode-se afirmar que o teste permite identificar
O composto representado abaixo corresponde a um aminoácido, comercialmente conhecido como “alanina”

De acordo com a estrutura desse composto e com os conceitos de ácido e de base de Bronsted e Lowry, a alanina pode apresentar

A Lei, à qual Lavoisier faz referência no texto, constitui um fundamento essencial para se compreender e representar as reações químicas. Essa Lei é conhecida como
PETROBRAS. Peça publicitária veiculada na TV Globo.
Não é simples definir energia, mas é fácil perceber sua existência. Nesse contexto, pode-se inferir que energia é a
Jornal o Estado do Maranhão. Adaptado.
Suponha que determinada gasolina seja composta de hidrocarbonetos com fórmula (C8H18). Nessas condições, as equações químicas que representam as reações de combustão completas do etanol e do octano, devidamente balanceadas, permitem afirmar que a combustão de
Leia a notícia abaixo divulgada em jornal maranhense.
“Furto de fiação elétrica, telefônica, de internet e de TV causa prejuízos em São Luís”. São cabos de cobre e de alumínio, levados por bandidos que furtam não apenas as redes de telefonia, mas principalmente a rede elétrica. Esses materiais são visados por criminosos por causa do alto valor de venda no mercado.
Jornal o Estado do Maranhão. Adaptado.
Pode-se afirmar em relação às propriedades dos metais
citados que
A VLI, empresa especializada em operações logísticas, além de incentivar por meio do projeto “Trilhos Culturais – Jovens multiplicadores” a difusão de diversos conhecimentos em comunidades que ficam às margens das linhas férreas brasileiras, a promoção e a participação social em ações educativas, incluiu em suas atividades o transporte de manganês, pelo corredor Centro Norte. Este metal apresenta vários estados de oxidação em diferentes espécies, como por exemplo, MnCO3, MnF3, K3MnO4 e MnO4 -2 . O manganês é transportado da cidade paraense, Marabá, até o porto do Itaqui, passando pela estrada de ferro Carajás, e segue em navios para outras cidades do litoral brasileiro, como também, para a Europa, Ásia e Estados Unidos.
Jornal o Estado do Maranhão.
Os números de oxidação do manganês nas espécies relacionadas, no texto, respectivamente, são
I. reatividade com NaHCO3, liberando gás;
II. reatividade com CH3OH, em meio ácido;
III. em meio aquoso apresenta pH menor que 7.
A partir dessas informações, pode-se dizer que este composto pertence à função orgânica:
1. A primeira célula (I) contém uma solução de AgNO3 entre dois eletrodos de prata;
2. A segunda (II) contém uma solução de um único sal de ouro (onde o nox do ouro é desconhecido) entre dois eletrodos de ouro.
Deixando a corrente passar durante certo tempo por este conjunto, observa-se que no catodo da célula (I) são depositados 1,079 g de prata, enquanto no catodo de célula (II) são depositados 0,657 g de ouro. Sabendo que no cátodo de cada célula ocorre somente um tipo de reação, qual das opções a seguir contém a afirmação FALSA em relação aos procedimentos e informações relacionados com a questão?
Dados: (1F = 96.500C).
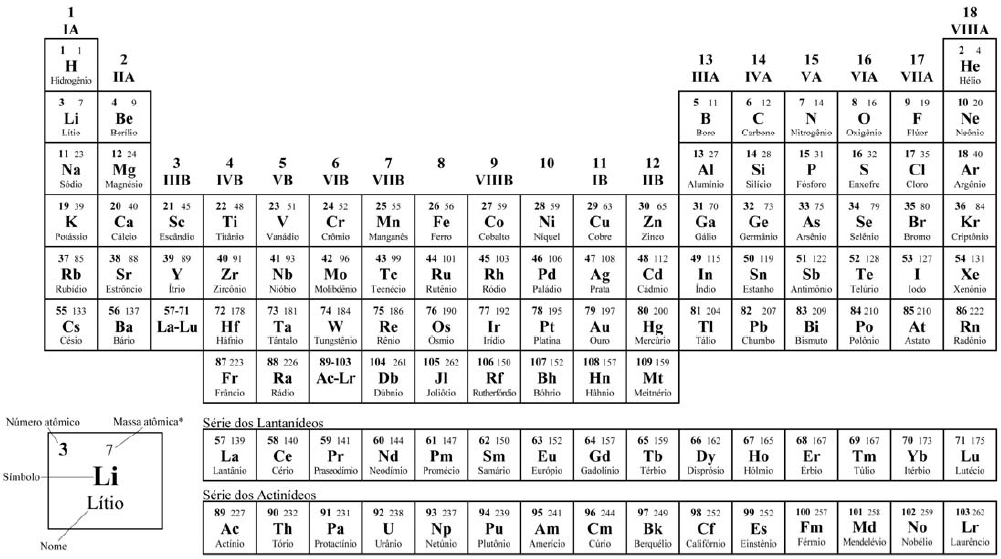
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Os coeficientes de solubilidade (C.S.) aproximados do cloreto de potássio e do dicromato de potássio, em g/100 g de H2O, são fornecidos na tabela a seguir:
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)