Questões de Vestibular Sobre química
Foram encontradas 6.605 questões

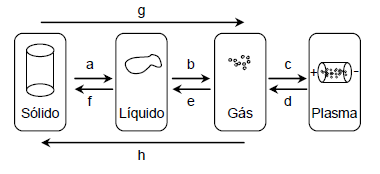 1) As transformações a, b, c e g ocorrem com o
aumento da entropia.
1) As transformações a, b, c e g ocorrem com o
aumento da entropia.
2) As transformações g e h correspondem à sublimação e à condensação, respectivamente.
3) As transformações e e f correspondem à condensação e à solidificação, respectivamente.
Está(ão) correta(s):
1) O NOX do cobalto é +3, pois tem-se o íon Co3+ .
2) Apresenta ligações iônicas e covalentes coordenadas.
3) O íon nitrato apresenta carga 1−.
Está(ão) correta(s):
De acordo com os dados fornecidos sobre o Paraquat, determine a sua fórmula mínima e a sua fórmula molecular, respectivamente.
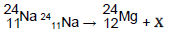
para completar a equação dessa reação nuclear, a espécie X deve ser:
Na reação abaixo:
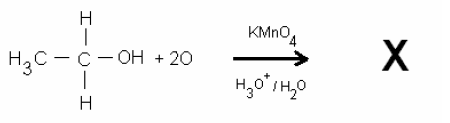
O produto X obtido é:
Os compostos:
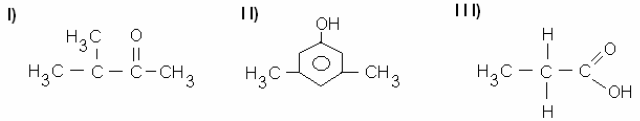
Pertencem, respectivamente, às funções orgânicas:
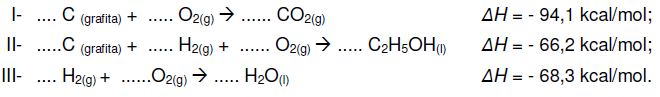
Sabendo-se que a variação de entalpia (∆H) de uma reação qualquer depende somente dos estados iniciais dos reagentes e do estado final dos produtos, marque a alternativa que corresponde aos coeficientes mínimos para a correta estequiometria das reações I, II e III, assim como a quantidade de calor produzida na combustão de 9,2 kg de álcool etílico líquido produzido [C2H5OH(l)], a partir dos coeficientes mínimos encontrados.
I- Sua Geometria é angular.
II- Forma Ligações de Pontes de Hidrogênio.
III- Solubiliza substâncias de baixa polaridade como, por exemplo, os óleos.
IV- Apresenta ligações tipo covalentes polarizadas.
V- Apresenta-se nos três estados físicos da matéria.
Nenhum lugar da casa se parece tanto com um laboratório de química quanto a cozinha, onde diversos ingredientes são misturados, queimados, fermentados e submetidos a processos dignos de experiências científicas. Assim como no laboratório, ter noções de química é essencial para que o cozinheiro consiga preparar corretamente os pratos, até os mais simples. Veja, por exemplo, como levar à perfeição a arte de cozinhar ovos.
Ritalina é o nome comercial do metilfenidato, droga frequentemente receitada para pacientes com transtorno do déficit de atenção e hiperatividade (TDAH). A fórmula estrutural do fenilfenidato está representada a seguir:
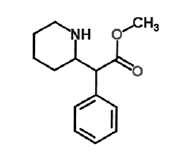
A respeito dessa substância foram feitas algumas afirmações:
I. Apresenta fórmula molecular C14H19NO2.
II. Um comprimido com 20 mg apresenta menos de 1,0 x 10-5 mol dessa substância.
III. A molécula apresenta carbono quiral.
IV. Apresenta as funções amina e ácido carboxílico.
• Estão corretas apenas as afirmações:
Foi realizada a combustão do gás butano em reator fechado. Inicialmente, a pressão parcial de gás butano era de 100 mbar, enquanto a pressão parcial de gás oxigênio era de 500 mbar.
• Considerando que todo butano e oxigênio foram consumidos e que os únicos produtos formados foram água, dióxido de carbono e monóxido de carbono, pode-se afirmar que a relação entre a pressão parcial de CO e a pressão parcial de CO2, após o término da reação, é aproximadamente igual a
O elemento de número atômico 117 foi o mais novo dos elementos artificiais obtidos em um acelerador de partículas. Recentemente, a IUPAC (União Internacional de Química Pura e Aplicada) anunciou que o nome sugerido para esse novo elemento é Tennessino. Alguns átomos do isótopo 293 desse elemento foram obtidos a partir do bombardeamento de um alvo contendo 13 mg de 249Bk por um feixe de núcleos de um isótopo específico. A reação produziu quatro nêutrons, além do isótopo 293 do elemento de número atômico 117.
• O isótopo que compõe o feixe de núcleos utilizado no acelerador de partículas para a obtenção do Tennessino é melhor representado por
A metilamina e a etilamina são duas substâncias gasosas à temperatura ambiente que apresentam forte odor, geralmente caracterizado como de peixe podre.
Uma empresa pretende evitar a dispersão desses gases e para isso adaptou um sistema de borbulhamento do gás residual do processamento de carne de peixe em uma solução aquosa.
• Um soluto adequado para neutralizar o odor da metilamina e etilamina é
O trióxido de enxofre (SO3) é obtido a partir da reação do dióxido de enxofre (SO2) com o gás oxigênio (O2), representada pelo equilíbrio a seguir.
2 SO2(g) + O2(g) 2 SO3(g) ΔHθ = - 198 kJ
A constante de equilíbrio, KC, para esse processo a 1000o C é igual a 280. A respeito dessa reação, foram feitas as seguintes afirmações:
I. A constante de equilíbrio da síntese do SO3 a 200o C deve ser menor que 280.
II. Se na condição de equilíbrio a 1000o C a concentração de O2 é de 0,1 mol.L-1 e a concentração de SO2 é de 0,01 mol.L-1, então a concentração de SO3 é de 2,8 mol.L-1.
III. Se, atingida a condição de equilíbrio, o volume do recipiente for reduzido sem alteração na temperatura, não haverá alteração no valor da constante de equilíbrio, mas haverá aumento no rendimento de formação do SO3.
IV. Essa é uma reação de oxirredução, em que o dióxido de enxofre é o agente redutor.
• Estão corretas apenas as afirmações:
Coluna A
1. Isomeria de compensação
2. Isomeria geométrica
3. Isomeria de cadeia
4. Isomeria óptica
Coluna B
( ) ciclopropano
( ) etóxi-etano
( ) bromo-cloro-fluoro-metano
( ) 1,2-dicloro-eteno
A sequência correta dos números da coluna B, de cima para baixo, é
