Questões de Vestibular Sobre química
Foram encontradas 6.605 questões


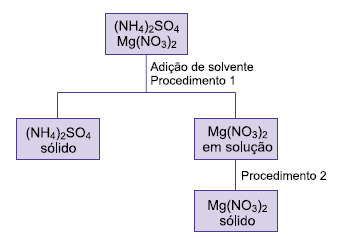
O solvente adicionado e os procedimentos 1 e 2 foram, respectivamente,
Ca10(PO4)6(OH)2 (s) + H+ → 10 Ca+2 (aq.) + 6 HPO4 -2 (aq.) + 2 H2O (l)
Em relação à reação de degradação da hidroxiapatita, são todas substâncias que impedem a solubilização do esmalte dentário:
Dados: Massas atômicas (g/mol): Enxofre = 32,06; Cálcio = 40,08; Oxigênio = 16,00
Considerando os dados apresentados, qual é a massa de óxido de cálcio (em gramas) necessária para o preparo de 50 litros da solução que será usada no pomar de peras?
Considere: O sistema adiabático, uma combustão completa a 1200 oC e que os gases gerados são gases ideais. Dados: R = 0,082 atm.L.K-1 .mol-1 ; Massa Molar (C6H12O6) = 180 g/mol.
A pressão interna do recipiente no momento exato da combustão da amostra é de:
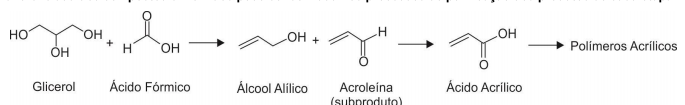
Assinale a alternativa que apresenta somente compostos que reagem com solução aquosa de bicarbonato de sódio, gerando gás carbônico.
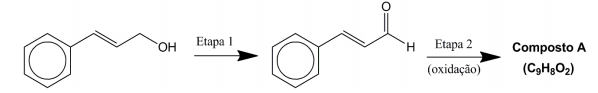
Com relação ao assunto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) O composto mostrado como matéria-prima para a síntese do cinamaldeído é um fenol. ( ) A Etapa 1 é uma oxidação. ( ) O produto formado na Etapa 2 é uma cetona. ( ) A estrutura apresentada para o cinamaldeído representa o isômero trans.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Nos processos hidrometalúrgicos de obtenção do cobre metálico a partir da calcopirita (CuFeS2), os componentes desse minério são inicialmente separados utilizando-se solução aquosa de cloreto férrico (FeCl3), como indicado pela seguinte equação:
CuFeS2 (s) + 4 Fe+3 (aq.) → Cu+2 (aq.) + 5 Fe+2 (aq.) + 2 S (s)
Sabendo que o número de oxidação do cobre na calcopirita é +2, considere as seguintes afirmativas a respeito da ação redox dos reagentes da equação apresentada:
1. O S-2 (aq.) é o agente oxidante.
2. O Fe+3 (aq.) é o agente oxidante.
3. O CuFeS2 (s) é o agente redutor.
4. O Cu+2 (aq.) é o agente redutor.
Assinale a alternativa correta.

A fórmula estrutural desse hidrocarboneto é
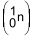 ,
forma dois nuclídeos radioativos: o bário-144, que decai emitindo partículas beta
,
forma dois nuclídeos radioativos: o bário-144, que decai emitindo partículas beta 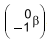 , e o nuclídeo X. Esse bombardeamento produz também três nêutrons, que colidirão com
outros núcleos de urânio, causando uma reação em cadeia.
O nuclídeo produzido pelo decaimento do bário-144 e o nuclídeo X são, respectivamente,
, e o nuclídeo X. Esse bombardeamento produz também três nêutrons, que colidirão com
outros núcleos de urânio, causando uma reação em cadeia.
O nuclídeo produzido pelo decaimento do bário-144 e o nuclídeo X são, respectivamente, 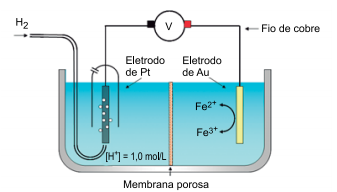
(https://mycourses.aalto.fi. Adaptado.)
Considere os eletrodos de platina e de ouro inertes e os potenciais de redução das espécies químicas presentes nas soluções:

Durante o funcionamento da célula galvânica representada na figura,
A tabela apresenta as pressões de vapor, à mesma temperatura, de três substâncias polares I, II e III.
Substância Pressão de vapor (mmHg)
I 60
II 200
III 260
Considerando as informações fornecidas, pode-se afirmar
que
A massa molar dessa substância é
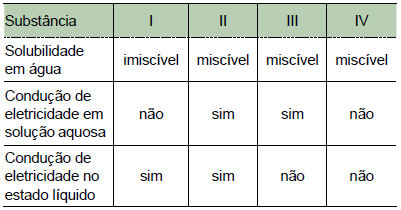
A natureza iônica é observada somente
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + 2CO2
A massa de bicarbonato de sódio necessária para a neutralização completa do ácido sulfúrico contido nessa solução é igual a

(Álvaro M. Barcelos. Propriedades Químicas. Adaptado.)
A equação química que representa o fenômeno ilustrado e a propriedade periódica relacionada a esse efeito são, respectivamente:
