Questões de Vestibular Sobre química
Foram encontradas 6.436 questões
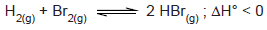
A tabela a seguir tem duas colunas, uma que indica um tipo de perturbação do equilíbrio e outra que indica a situação final do equilíbrio restabelecido.

A associação CORRETA de perturbação e situação final do equilíbrio restabelecido é indicada na alternativa
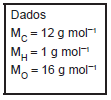
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é:
Instrução: Leia atentamente o texto abaixo para responder a questão.


A entalpia de combustão do carbono, a 25 °C, é de 393,5 kJ.mol−1. Considerando 1,0 kg de turfa, um tipo de carvão mineral que contém somente 60% de carbono, em média, a energia liberada, em kJ, somente pela queima de carbono é de, aproximadamente,
Dado:
massa molar do C = 12 g.mol−1
Instrução: Leia atentamente o texto abaixo para responder a questão.


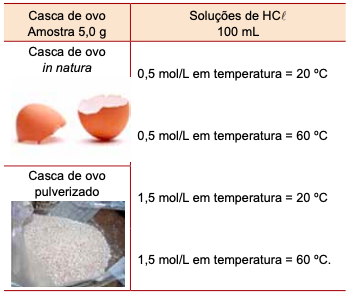
Foi proposto a um grupo de alunos um experimento sobre a reação da casca de ovos com soluções de ácido clorídrico (HCl), usando os materiais e as condições descritas na tabela.
(http://www.saude.co/ e www.animalnatural.com.br. Adaptado)
O experimento consistia em medir o tempo da reação da solução ácida com a amostra de casca de ovo. Para a preparação do experimento, foi removida a película de material orgânico que compõe a casca de ovo, tanto para o seu uso in natura como para preparação da amostra em pó.
A combinação que apresentou o menor tempo de reação foi
aquela que usou
Algumas categorias de câncer de tireoide podem ser tratadas por meio de um tipo de radioterapia em que o radioisótopo é disponibilizado no interior do organismo do paciente. Dessa forma, a radiação é emitida diretamente no órgão a ser tratado e os efeitos colaterais são diminuídos. O radioisótopo usado nesse tipo de radioterapia decai de acordo com a equação.
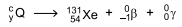
O radioisótopo 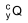 é inserido em cápsulas. Para realizar a
radioterapia, o paciente é isolado em instalação hospitalar
adequada onde ingere uma dessas cápsulas e permanece
internado até que a atividade do radioisótopo atinja valores
considerados seguros, o que ocorre após o tempo mínimo
correspondente a 3 meias-vidas do radioisótopo.
é inserido em cápsulas. Para realizar a
radioterapia, o paciente é isolado em instalação hospitalar
adequada onde ingere uma dessas cápsulas e permanece
internado até que a atividade do radioisótopo atinja valores
considerados seguros, o que ocorre após o tempo mínimo
correspondente a 3 meias-vidas do radioisótopo.
A figura apresenta a curva de decaimento radioativo para 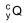 .
.
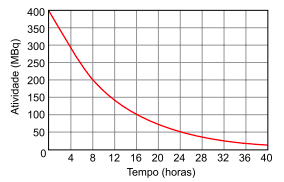
(http://www.scielo.br/pdf/abem/v51n7/a02v51n7.pdf. Adaptado)
O radioisótopo 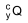 e o tempo mínimo que o paciente deve
permanecer internado e isolado quando é submetido a esse
tipo de radioterapia são, respectivamente,
e o tempo mínimo que o paciente deve
permanecer internado e isolado quando é submetido a esse
tipo de radioterapia são, respectivamente,
Em uma aula de laboratório de química, foi realizado um experimento que consistiu em adicionar em um béquer 300 g de água, em temperatura ambiente, e certa quantidade do sal sulfato de magnésio hexaidratado (MgSO4 . 6H2O) até formar uma solução saturada com corpo de fundo. Essa mistura foi aquecida até completa solubilização do sal, que ocorreu quando a temperatura atingiu 50 ºC. Na sequência, deixou-se a solução resfriar até 20 ºC e verificou-se novamente a presença do sal cristalizado no fundo do béquer.
Foram fornecidos aos alunos os dados de solubilidade desse sal nas duas temperaturas medidas.
Com as informações fornecidas, foram calculadas as massas do sal presente na solução a 50 ºC e do sal cristalizado
a 20 ºC. Esses resultados são corretamente apresentados,
nessa ordem, em:
A indústria de alimentos emprega diversos aditivos em seus produtos, como vitaminas, corantes e agentes para prevenção da degradação do produto. Na figura, são representadas as fórmulas estruturais de quatro dessas substâncias empregadas pela indústria de alimentos.
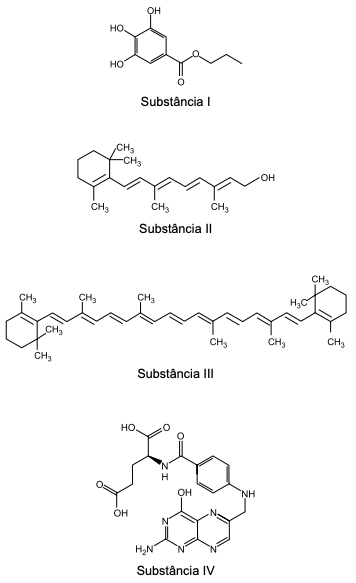
(Ribeiro, E.; Seravalli, E. Química dos Alimentos,
Editora Blucher, 2007. Adaptado)
Dentre essas substâncias, as que são solubilizadas em água
durante a preparação dos alimentos industrializados são
aquelas correspondentes às formulas estruturais identificadas por
Uma das etapas do tratamento de água para a rede de distribuição urbana consiste na sua desinfecção, que é feita pelo ácido hipocloroso (HClO) que se forma quando se adiciona hipoclorito de sódio na água a ser tratada. Porém, se a água tiver contaminantes orgânicos, reações adversas podem ocorrer, como aquela entre o contaminante acetona (C₃H₆O) e o ácido hipocloroso, que resulta na solução de ácido acético (CH₃COOH), água e o agente carcinogênico clorofórmio (CHCl₃ ), como representado na equação:
C₃H₆O (aq) + 3HClO (aq)
CH₃COOH (aq) + CHCl₃ (aq) + 2 H₂O (l)
(T.W. Swaddle, Applyed Inorganic Chemistry, University
of Calgary Press, 1990. Adaptado)
Considerando-se o tratamento de 1 m³ de água contaminada com acetona na concentração 5,8 mg/L, a quantidade máxima, em mol, de ácido hipocloroso que poderá ser consumida na reação com a acetona é igual a
I. Alguns elementos são classificados de cisurânicos, porque apresentam número atômico inferior a 92, o do elemento urânio, como por exemplo, plutônio e amerício.
II. A IUPAC propôs que as famílias seriam indicadas por algarismos arábicos de 1 a 18, eliminando-se as letras A e B.
III. Na tabela atual existem dezoito períodos, sendo que o número do período corresponde à quantidade de níveis (camadas) eletrônicos que os elementos químicos apresentam.
IV. Segundo a Lei periódica atual, os elementos químicos são agrupados em ordem crescente de número atômico.
Conclui-se que, estão corretas as afirmativas:
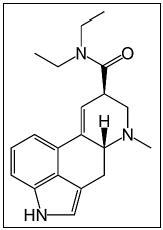 LSD
LSD 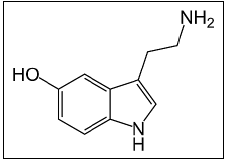 SEROTONINA
SEROTONINA 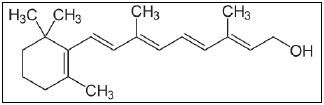 VITAMINA A
VITAMINA A 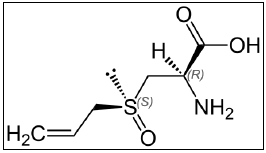 ALIINA (encontrado no alho fresco)
ALIINA (encontrado no alho fresco) 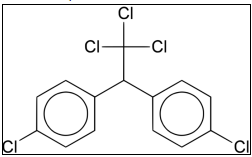 DDT
DDT Sobre estas substâncias, é incorreto afirmar que:
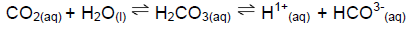 Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o
Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o 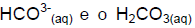 é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao
organismo, devido às alterações metabólicas, podendo causar a morte.
é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao
organismo, devido às alterações metabólicas, podendo causar a morte. Levando em conta as informações acima, é correto afirmar que
Coluna 1
1 - Sabões e detergentes 2 - Gás natural 3 - Gás de cozinha 4 - Plásticos 5 - Óleos e gorduras 6 - Vinagre
Coluna 2
A - Propano (C3H8) e Butano (C4H10)
B - Polietileno, PET, PVC entre outros.
C - A legislação brasileira estabelece em 4% o teor mínimo de ácido acético.
D - Substâncias insolúveis em água, de origem vegetal ou animal constituídas de triglicerídeos, que são formados da condensação entre glicerol e ácidos graxos.
E - Metano (CH4)
F - Reações de saponificação, que nada mais são do que uma hidrólise alcalina. Um triéster (triglicerídeo) reage com uma base em meio aquoso e forma um sal e um poliálcool.
Marque a alternativa que relaciona corretamente as colunas 1 e 2.
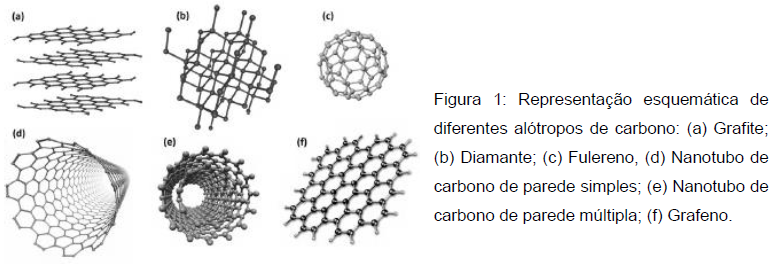
Fonte: ZARBIN, Aldo J. G.; OLIVEIRA, Marcela M.. Nanoestruturas de carbono (nanotubos, grafeno): Quo Vadis?. Quím. Nova, São Paulo, v. 36, n. 10, p. 1533-1539, 2013.
Disponível em:<http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40422013001000009&lng=en&nrm=iso>. Acesso em: 02 Set. 2017.
Com relação a este assunto, são feitas as seguintes afirmações.
I - O átomo de Carbono-12 possui em seu núcleo seis nêutrons e seis prótons.
II - A descoberta do
 (Fig. 1c), que tem a forma de uma bola de futebol, impulsionou a descoberta
de outras estruturas de fulerenos, principalmente materiais nanoestruturados, como os nanotubos
de carbono. Estas substâncias simples possuem uma massa molar de 720 g/mol.
(Fig. 1c), que tem a forma de uma bola de futebol, impulsionou a descoberta
de outras estruturas de fulerenos, principalmente materiais nanoestruturados, como os nanotubos
de carbono. Estas substâncias simples possuem uma massa molar de 720 g/mol. III - O átomo de carbono tem seis elétrons na sua eletrosfera, por isso, é chamado de hexavalente. Sendo assim, precisa apenas mais dois elétrons na sua camada de valência (camada mais externa) para obedecer à regra do octeto.
IV - Numa combustão completa, as moléculas orgânicas presentes nos combustíveis fósseis se ligam completamente ao gás oxigênio formando gás carbônico, que é um dos grandes responsáveis pelo efeito estufa.
V - Quanto à disposição dos átomos de carbono na cadeia carbônica das moléculas orgânicas, podemos classificá-las em Cadeia Normal (Reta ou Linear) ou Cadeia Ramificada.
Assinale a alternativa correta.
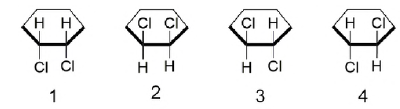
O estudante propôs uma estrutura a mais porque considerou em sua resposta que:
