Questões de Vestibular Sobre química
Foram encontradas 6.520 questões
Em seu livro Como se faz Química, o Professor Aécio Chagas afirma que “quem transforma a matéria, sem pensar sobre ela, não é, e jamais será um químico”. Considere alguns produtos que um cozinheiro reconhece nas linhas 1-4 do quadro a seguir, e aqueles que um químico reconhece nas linhas 5-8.
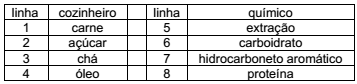
Um químico, familiarizado com as atividades culinárias,
relacionaria as linhas
Com a crescente crise mundial de dengue, as pesquisas pela busca tanto de vacinas quanto de repelentes de insetos têm se intensificado. Nesse contexto, os compostos I e II abaixo representados têm propriedades muito distintas: enquanto um deles tem caráter ácido e atrai os insetos, o outro tem caráter básico e não os atrai.
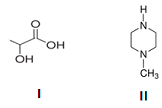
Baseado nessas informações, pode-se afirmar
corretamente que o composto
I O cloreto de cálcio é um sólido iônico.
II O cloreto de cálcio sólido é um bom condutor de eletricidade.
III Para ser usado como “secante de armário", o sal deve ser higroscópico.
São verdadeiras:
A solubilidade desse composto a 25.0°C, em água pura e em uma solução de pH igual a 13.00, será, respectivamente, em molL-1 :
O sal formado entre o ácido bórico e o hidróxido de magnésio apresenta a seguinte composição centesimal:
PCl3(g) + Cl2(g) PCl5(g)
Sob essas condições, o efeito causado sobre a referida reação é:
Em relação à eletrólise,
O Nobel da Paz de 2013 foi entregue à Organização para a Proibição das Armas Químicas, o que reforçou a preocupação mundial quanto à erradicação desse tipo de armamento. O VX é um agente químico altamente tóxico, classificado como arma de destruição em massa. A eliminação desse agente é realizada via degradação, que pode ocorrer por três caminhos, tal como ilustrado. No entanto, o composto “5" também pode atuar como arma química, por ser muito mais tóxico que os outros produtos da degradação.
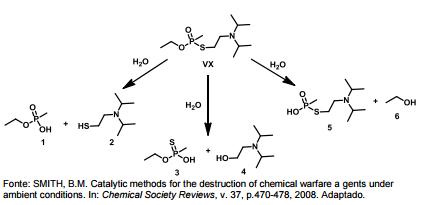
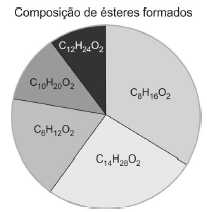
O ácido carboxílico presente em maior quantidade na amostra analisada é o:
Com relação à isomeria, numere a coluna da direita de acordo com sua correspondência com a coluna da esquerda.
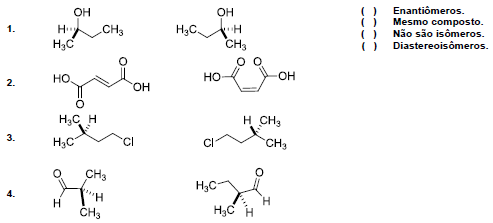
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
- Líquido A: H2O
Nº de gotas / mL 20
- Líquido B: CH3CH2OH Nº de gotas / mL 50
- Líquido C: mistura H2O / CH3CH2OH Nº de gotas / mL 40
Um grupo de amigos percebe que, ao se gotejar um líquido sobre uma moeda, forma-se uma gota sobre essa moeda. Após adições sucessivas, a gota colapsa e o líquido espalha-se sobre a moeda. No entanto, eles verificam que, dependendo do líquido, o comportamento é diferente, mas o material da moeda não influencia. Assim, eles fazem um desafio para ver quem consegue utilizar o menor volume de líquido para cobrir toda a superfície da moeda, sendo que eles podem escolher entre os líquidos A, B e C e utilizar uma moeda de 5 ou 10 centavos.
Quem ganhou o desafio?
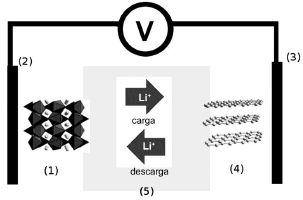
Quando a bateria está em uso (atuando como uma pilha), o anodo corresponde ao componente:
Os polímeros biodegradáveis podem ser empregados na confecção de sacolas plásticas utilizadas nos supermercados. Esses polímeros apresentam estruturas de cadeias alifáticas com grupos funcionais hidrolisáveis.
A fórmula estrutural que representa o monômero de um polímero biodegradável é
Um certo polímero é produzido a partir de um monômero, que é um hidrocarboneto que contém somente uma instauração. A análise elementar por combustão completa de 0,5 mol de moléculas desse hidrocarboneto resultou em 1,5 mol de moléculas de CO2 .
A massa molar, em g.mol–1 , desse monômero é
O hidrogênio para células a combustível de uso automotivo poderá ser obtido futuramente a partir da reação de reforma do etanol. Atualmente, nessa reação, são gerados subprodutos indesejados: etanal (I) e etanoato de etila (II). Porém, pesquisadores da UNESP de Araraquara verificaram que, com o uso de um catalisador adequado, a produção de hidrogênio do etanol poderá ser viabilizada sem subprodutos.
(Revista Pesquisa Fapesp, 234, agosto de 2015. Adaptado)
A reação da transformação de etanol no subproduto I e a substância que reage com o etanol para formação do subproduto II são, correta e respectivamente,
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio

A concentração máxima permitida para fenóis em águas
não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a
concentração máxima permitida para fenóis pela resolução
n° 357 do CONAMA é de 0,003 mg/L.
Os químicos do laboratório de análises de uma indústria de tintas prepararam cinco amostras, cada uma com 1000 mL de efluente do processo, contendo fenol. A quatro delas, adicionaram – a cada uma separadamente – 0,1 mol das seguintes substâncias: KBr, NaCl, NaOH, HCl. A quinta amostra foi mantida apenas com o efluente. Após esse procedimento, fizeram análises da concentração de fenolato, C6 H5 O– , por instrumento de medida, em cada uma das cinco amostras.
Ao final dessa pesquisa, os químicos concluíram corretamente que a amostra que apresentou maior concentração de íon fenolato, dentre as cinco, foi aquela contendo
O fenol é um composto químico altamente tóxico encontrado em efluentes (resíduos aquosos de processos químicos) de variadas indústrias como a farmacêutica, de tintas e de papel e celulose.
O fenol se ioniza em água de acordo com o equilíbrio

A concentração máxima permitida para fenóis em águas
não cloradas é de 0,1 mg/L. Contudo, em águas cloradas, a
concentração máxima permitida para fenóis pela resolução
n° 357 do CONAMA é de 0,003 mg/L.
Em um experimento em laboratório de química, montou-se uma célula eletrolítica de acordo com o esquema:
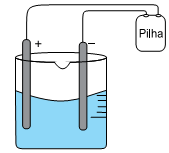
Usaram-se como eletrodo dois bastões de grafite, uma solução aquosa 1,0 mol.L–1 de CuSO4 em meio ácido a 20 °C e uma pilha.
Alguns minutos, após iniciado o experimento, observaram-se a formação de um sólido de coloração amarronzada sobre a superfície do eletrodo de polo negativo e a formação de bolhas na superfície do eletrodo de polo positivo.
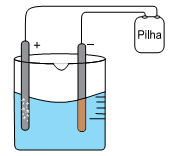
Com base nos potenciais de redução a 20 °C,
Cu2+ (aq) +2e– → Cu (s) + 0,34 V
2H+ (aq) + 2e– → H2 (g) 0,00 V
O2 (g) + 4H+ (aq) + 4e– → H2O (l) + 1,23 V
É correto afirmar que se forma cobre no
O ácido nítrico é um importante insumo para produção de fertilizantes, explosivos e tintas. Sua produção industrial é feita pelo processo Ostwald, em três etapas que podem ser representadas pelas reações:
I. 6 NH3 (g) + 15/2 O2 (g) → 6 NO (g) + 9 H2O (g) ∆H = – 1378 kJ
II. 6 NO (g) + 3 O2 (g) → 6 NO2 (g) ∆H = – 339 kJ
III. 6 NO2
(g) + 2 H2O (g) → 4 HNO3
(aq) + 2 NO (g) ∆H = – 270 kJ
O ácido nítrico é um importante insumo para produção de fertilizantes, explosivos e tintas. Sua produção industrial é feita pelo processo Ostwald, em três etapas que podem ser representadas pelas reações:
I. 6 NH3 (g) + 15/2 O2 (g) → 6 NO (g) + 9 H2O (g) ∆H = – 1378 kJ
II. 6 NO (g) + 3 O2 (g) → 6 NO2 (g) ∆H = – 339 kJ
III. 6 NO2
(g) + 2 H2O (g) → 4 HNO3
(aq) + 2 NO (g) ∆H = – 270 kJ