Questões de Vestibular Sobre química
Foram encontradas 6.467 questões
Responda à questão com base na tabela abaixo sobre o rótulo da garrafa de uma determinada marca de refrigerante.

* Valores Diários com base numa dieta de 2 000 kcal ou 8 400 kJ
Responda à questão com base na tabela abaixo sobre o rótulo da garrafa de uma determinada marca de refrigerante.

* Valores Diários com base numa dieta de 2 000 kcal ou 8 400 kJ
H3C-NH2(g) + H2O(l) → H3C-NH3+ (aq) + OH- (aq)
De acordo com a reação química equacionada e para completar as lacunas acima se deve utilizar a seguinte sequência:
Considere o sistema em equilíbrio a 25°C e 1 atm que representa a queima ou combustão do metanol líquido:
2CH3OH (l) + 3 O2 (g) ⇄ 2CO2(g) + 4H2O(l) H = -1452 kJ
Assinale a alternativa VERDADEIRA:

II) O ácido nítrico em água tem como base conjugada o íon nitrato, NO .
III) Para cada litro de solução de ácido nítrico obtido tem-se 980 g deste ácido dissolvidos.
IV) A concentração da solução aquosa de ácido nítrico obtido é de 15,6 mol/l.
V) Por meio de uma destilação é possível elevar o teor de ácido nítrico na solução obtida.
A sequência correta que corresponde, respectivamente, à questão é

II) A amônia é um composto gasoso de caráter básico.
III) O ácido nítrico é um oxiácido monoprótico.
IV) Na amônia, o nitrogênio tem número de oxidação +3.
V) A reação que ocorre na etapa 6 é homogênea.
A sequência correta que corresponde, respectivamente, à questão é

II) A etapa 2 de separação dos gases ocorre por liquefação seguida de destilação fracionada.
III) O processo Haber-Bosch consiste em uma reação de síntese total.
IV)Asoma dos coeficientes mínimos e inteiros da equação na etapa 4 é 19.
V) A etapa 4 é uma reação catalítica de oxirredução.
A sequência correta que corresponde, respectivamente, à questão é
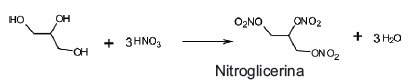
A nitração em escala industrial também é realizada na presença de uma mistura dos ácidos nítrico e sulfúrico, conhecida como mistura sulfonítrica. Sobre a reação de nitração da glicerina e as substâncias que agem como reagentes e seus produtos é correto afirmar que
O elemento químico X, comum às três ligas, latão (Zn + X), bronze (Sn + X) e ouro vermelho (Au + X), é isoeletrônico com Zn2+ quando seu próprio número de oxidação é igual a +1, e conserva sua alta condutibilidade elétrica e térmica ao compor as ligas. O elemento químico com as características citadas é
Considere a figura com a estrutura do acetaminofen e as seguintes afirmações:
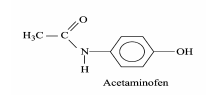
I. O acetaminofen apresenta fórmula molecular C8H9NO2. II. O grupo funcional amida é que confere o caráter básico do acetaminofen. III. A absorção do ácido acetilsalicílico em um indivíduo é maior no estômago do que no intestino, devido ao baixo pH do suco gástrico. IV. Os fenóis apresentam menor acidez do que os ácidos carboxílicos.
São corretas as afirmações
As enzimas de alguns microorganismos transforma o açúcar em álcool e gás carbônico. A cerveja, por exemplo, (com 3 % a 7 %, em volume, de álcool) é resultado da fermentação da cevada. A cachaça, por sua vez, (com 38 % a 50 %, em volume, de álcool) é obtida em duas etapas: - a fermentação, na qual se consegue produzir até 20 %, em volume, de álcool e, - a destilação, na qual o caldo fermentado é destilado, o que leva a um aumento da concentração do álcool.
Considerando o exposto, podemos afirmar que:
CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g).
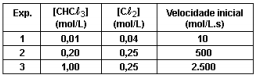
Usando esses dados, assinale o correto.
1 - HBr 2 - BaO 3 - CaCl2 4 - SiO2 5 - B2O3
Quais delas apresentam ligação tipicamente iônica?
Al2(SO4)3 + 3Ca(OH)2 → 2 Al(OH)3 + 3CaSO4
Para tratar 1,0x106m3 de água foram adicionadas 17 toneladas de Al2(SO4)3. Qual a massa de Ca(OH)2 necessária para reagir completamente com esse sal? Dados: massas molares Al2(SO4)3 = 342 g/mol Ca(OH)2 = 74 g/mol
I. a molécula do benzeno apresenta três ligações duplas entre átomos de carbono; II. a energia de ligação entre os átomos de carbono no benzeno é maior que a da benzina; III. os átomos de carbono na benzina apresentam geometria tetraédrica; IV. os ângulos de ligação entre os átomos de carbono no benzeno são de 60°.
As afirmativas corretas são aquelas contidas em: