Questões de Vestibular Sobre química
Foram encontradas 6.520 questões
Durante séculos, filósofos e alquimistas acreditaram que a matéria era constituída de quatro elementos fundamentais: terra, água, ar e fogo. Hoje, contudo, reconhecemos a existência de muito mais do que quatro elementos e alcançamos uma compreensão mais aprofundada sobre o que, de fato, são água, ar, terra e fogo.
Sobre esse assunto, são feitas as seguintes afirmativas:
I. A água é uma substância simples.
II. O ar é uma solução.
III. A terra é uma mistura heterogênea.
IV. O fogo é uma reação redox endotérmica.
São corretas somente as afirmativas:
Durante o verão, verificam-se habitualmente tempestades em muitas regiões do Brasil. São chuvas intensas e de curta duração, acompanhadas muitas vezes de raios. No litoral, essas tempestades constituem um risco para os banhistas, pois a água salgada é eletricamente condutora. Isso se explica pelo fato de a água salgada conter grande quantidade de _________, como Na+ e Cl−, livres para transportar carga elétrica no meio. Uma maneira de liberar essas partículas é dissolver sal de cozinha em um copo de água. Nesse processo, os _________ existentes no sal sofrem _________.
As expressões que completam corretamente o texto são, respectivamente:
Três provetas com capacidade para 100 mL foram preenchidas cada uma com um mol de uma substância líquida nas condições ambientes. O resultado foi o seguinte:
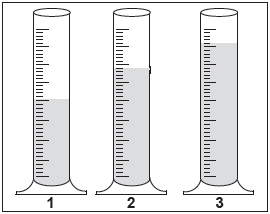 Com base nas informações acima, é possível que as substâncias nas provetas 1, 2 e 3 sejam, respectivamente,
Com base nas informações acima, é possível que as substâncias nas provetas 1, 2 e 3 sejam, respectivamente, TEXTO 8
CAPÍTULO XVIII
Rubião e o cachorro, entrando em casa, sentiram, ouviram a pessoa e as vozes do finado amigo. Enquanto o cachorro farejava por toda a parte, Rubião foi sentar-se na cadeira, onde estivera quando Quincas Borba referiu a morte da avó com explicações científicas. A memória dele recompôs, ainda que de embrulho e esgarçadamente, os argumentos do filósofo. Pela primeira vez, atentou bem na alegoria das tribos famintas e compreendeu a conclusão: “Ao vencedor, as batatas!”. Ouviu distintamente a voz roufenha do finado expor a situação das tribos, a luta e a razão da luta, o extermínio de uma e a vitória da outra, e murmurou baixinho:
— Ao vencedor, as batatas!
Tão simples! tão claro! Olhou para as calças de brim surrado e o rodaque cerzido, e notou que até há pouco fora, por assim dizer, um exterminado, uma bolha; mas que ora não, era um vencedor. Não havia dúvida; as batatas fizeram-se para a tribo que elimina a outra a fim de transpor a montanha e ir às batatas do outro lado. Justamente o seu caso. Ia descer de Barbacena para arrancar e comer as batatas da capital. Cumpria-lhe ser duro e implacável, era poderoso e forte. E levantando-se de golpe, alvoroçado, ergueu os braços exclamando:
— Ao vencedor, as batatas!
Gostava da fórmula, achava-a engenhosa, compendiosa e eloquente, além de verdadeira e profunda. Ideou as batatas em suas várias formas, classificou-as pelo sabor, pelo aspecto, pelo poder nutritivo, fartou- -se antemão do banquete da vida. Era tempo de acabar com as raízes pobres e secas, que apenas enganavam o estômago, triste comida de longos anos; agora o farto, o sólido, o perpétuo, comer até morrer, e morrer em colchas de seda, que é melhor que trapos. E voltava à afirmação de ser duro e implacável, e à fórmula da alegoria. Chegou a compor de cabeça um sinete para seu uso, com este lema: AO VENCEDOR AS BATATAS.
Esqueceu o projeto do sinete; mas a fórmula viveu no espírito de Rubião, por alguns dias: — Ao vencedor as batatas! Não a compreenderia antes do testamento; ao contrário, vimos que a achou obscura e sem explicação. Tão certo é que a paisagem depende do ponto de vista, e que o melhor modo de apreciar o chicote é ter-lhe o cabo na mão.
(ASSIS, Machado de. Quincas Borba. São Paulo: Ática,
2011. p. 38-39.)
O brim é um tecido composto principalmente de algodão. É comumente tingido de índigo (colorante azul) que tem uma produção anual de 50 mil toneladas. A maioria dessa produção (95%) é destinada à indústria têxtil. Devido à baixa afinidade do índigo pela fibra de algodão, somente a superfície dos fios fica azul, deixando o núcleo da fibra com coloração branca. Estima-se que cerca de 15% do índigo usado na indústria têxtil é descartado como resíduo. Esse resíduo, quando não tratado corretamente, acaba causando sérios problemas ambientais.
O algodão tem em sua constituição 94% de celulose, cuja fórmula molecular é (C6 H10O5 )n. A celulose é um polissacarídeo formado por um único monômero (a glicose: C6 H12O6 ). Ela pode apresentar uma configuração aberta ou fechada, dependendo do ambiente químico.
Assinale a única alternativa correta com relação ao exposto acima:
TODO PIONEIRO É UM FORTE, pensava Bambico. Acredita nos sonhos. Se não fosse por ele, o mundo ainda estaria no tempo das cavernas... Quanto mais pensava nisso, mais se fortalecia.
Bambico chegara à Amazônia com as mãos vazias, vindo do Sul. Mas tinha na cabeça projetos grandiosos. Queria extrair da natureza toda a riqueza intacta, como o garimpeiro faz. Não desejava, entretanto, cavar rio e terra para achar pepitas de ouro. Não tinha vocação para tatu. Não faria como os garimpeiros: quando não havia mais nada, eles se mudavam, atrás de outros garimpos.
— Garimpeiro vive de ilusões. Eu gosto de projetos!
Que projetos grandiosos eram? Cortar árvores, exportar madeiras preciosas para a casa e a mobília dos ricos. Em seguida, semear capim, povoando os campos com as boiadas de nelore brilhando de tanta saúde. A riqueza estava acima do chão. A imensidão verde desaparecia no horizonte. Só de olhar para uma árvore, sabia quantos dólares cairia em seus bolsos. Quando ouvia os roncos das motosserras, costumava dizer, orgulhoso:
— Eis o barulho da fortuna!
Montes de serragem eram avistados de longe quando o visitante chegava às pequenas comunidades. Os caminhões de toras gemiam nas estradas esburacadas. Índios e caboclos eram afugentados à bala. A floresta se transformava num pó fino, que logo apodrecia. Quando os montes de serragem não apodreciam, eram queimados, sempre apressadamente. Por dias, os canudos negros de fumaça subindo pesadamente ao céu. Havia o medo dos fiscais. Quando apareciam, quase nunca eram vistos, era conveniente que houvesse pouca serragem...
Que história, a de Bambico! Teria muita coisa a contar para os netos que haveriam de chegar.
Em seu escritório, fumando um Havana, que um importador americano lhe presenteara, estufou o peito, vaidoso.
— Sim, muitas coisas! Quem te viu, quem te vê!
[...]
Sentia prazer com seus projetos grandiosos. Toda manhã se levantava para conquistar o mundo. Vereança era merreca. Não se rastejava em pequenos projetos. Muito menos desejava ser deputado... Ambicionava altos voos. Todo deputado era pau-mandado dos ricos. O Senado, sim, era o grande alvo. Lá, ele poderia afrontar esses “falsos profetas protetores da natureza". Essas ONGs de fachada... Lá, o seu cajado cairia sem dó, como um verdugo, sobre o costado dessa gente tola. Enquanto isso, ele poderia continuar seus projetos grandiosos. Cortar árvores, exportar madeiras preciosas para a casa e a mobília dos ricos, e semear capim.
Sonhara em ter uma dúzia de filhos, mas o destino lhe dera apenas dois. Sua mulher, após o segundo parto, ficara impossibilitada de procriar. Não queria fêmea entre os seus descendentes, mas logo no primeiro parto veio a decepção. Uma menina. Decepcionado, nada comentou com a esposa. No segundo, depois de uma gravidez tumultuada, veio o varão. Encheu-se de alegria. Com certeza, mais varões estavam para vir... [...]
(GONÇALVES, David. Sangue verde. São Paulo: Sucesso Pocket, 2014. p. 114-115.)
“ Não desejava, entretanto, cavar rio e terra para achar pepitas de ouro."
O cianeto de sódio (NaCN) é muito utilizado na extração do ouro. Ele facilita a oxidação do ouro e a sua solubilização. Para evitar a liberação de ácido cianídrico (HCN), que é um gás muito tóxico, essa etapa do processo é feita em meio alcalino.
Uma provável reação para essa etapa é descrita a seguir:
4Au + 8NaCN + O2 + 2H2 O → 4NaAu(CN)2 + 4NaOH
Em seguida, a recuperação do ouro (redução) é feita por precipitação através da adição de zinco em pó.
Assinale a única alternativa correta com relação às afirmações anteriormente expostas:
O outro
Ele me olhou como se estivesse descobrindo o mundo. Me olhou e reolhou em fração de segundo. Só vi isso porque estava olhando-o na mesma sintonia. A singularização do olhar. Tentei disfarçar virando o pescoço para a direita e para a esquerda, como se estivesse fazendo um exercício, e numa dessas viradas olhei rapidamente para ele no volante. Ele me olhava e volveu rapidamente os olhos, fingindo estar tirando um cisco da camisa. Era um ser de meia idade, os cabelos com alguns fios grisalhos, postura de gente séria, camisa branca, um cidadão comum que jamais flertaria com outra pessoa no trânsito. E assim, enquanto o semáforo estava no vermelho para nós, ficou esse jogo de olhares que não queriam se fixar, mas observar o outro espécime que nada tinha de diferente e ao mesmo tempo tinha tudo de diferente. Ele era o outro e isso era tudo. É como se, na igualdade de milhares de humanos, de repente, o ser se redescobrisse num outro espécime. Quando o semáforo ficou verde, nós nos olhamos e acionamos os motores.
(GONÇALVES, Aguinaldo. Das estampas. São Paulo: Nankin, 2013. p. 130.)
“Quando o semáforo ficou verde, nós nos olhamos e acionamos os motores."
Os motores de combustão interna conseguem transformar a energia química em energia mecânica. Na maioria dos automóveis, temos motores de ignição por centelha de quatro tempos. O ciclo de funcionamento de um motor de quatro tempos apresenta quatro etapas: admissão, compressão, combustão/expansão e exaustão. A respeito do texto acima, analise as afirmativas a seguir:
I-A energia liberada de uma reação de combustão é dada pelo balanço da energia necessária para romper as ligações do combustível e da energia necessária para formar as ligações dos produtos da reação, sendo que a primeira é sempre maior que a última.
II- Pode-se dizer que o aumento da temperatura na combustão leva ao aumento do grau de desordem do sistema.
III-Considerando-se apenas a câmara de combustão do motor, pode-se afirmar que os gases resultantes da combustão vão aumentar a pressão no interior desta.
IV-Os produtos de uma reação de combustão completa são sempre CO e H2O.
Em relação às proposições analisadas, assinale a única alternativa cujos itens estão todos corretos:
O outro
Ele me olhou como se estivesse descobrindo o mundo. Me olhou e reolhou em fração de segundo. Só vi isso porque estava olhando-o na mesma sintonia. A singularização do olhar. Tentei disfarçar virando o pescoço para a direita e para a esquerda, como se estivesse fazendo um exercício, e numa dessas viradas olhei rapidamente para ele no volante. Ele me olhava e volveu rapidamente os olhos, fingindo estar tirando um cisco da camisa. Era um ser de meia idade, os cabelos com alguns fios grisalhos, postura de gente séria, camisa branca, um cidadão comum que jamais flertaria com outra pessoa no trânsito. E assim, enquanto o semáforo estava no vermelho para nós, ficou esse jogo de olhares que não queriam se fixar, mas observar o outro espécime que nada tinha de diferente e ao mesmo tempo tinha tudo de diferente. Ele era o outro e isso era tudo. É como se, na igualdade de milhares de humanos, de repente, o ser se redescobrisse num outro espécime. Quando o semáforo ficou verde, nós nos olhamos e acionamos os motores.
(GONÇALVES, Aguinaldo. Das estampas. São Paulo: Nankin, 2013. p. 130.)
Aos cabelos grisalhos podem estar associados respeito, sabedoria ou desleixo. O fato é que muita gente recorre a diversos artifícios para cobri-los. Um deles é utilizar chá preparado com pétalas de hibisco e calêndula. O hibisco tem uma composição que contempla várias espécies químicas, como por exemplo glicídeos – como mucilagens e pectina –, proteínas, cálcio, ferro e fósforo, ácido ascórbico, ácido cítrico, ácido glicólico, ácido málico, ácido oxálico, ácido tartárico, ácido hibíscico e a lactona do ácido hidroxicítrico, compostos fenólicos, antocianidinas.
Sobre as espécies químicas citadas, assinale a única alternativa correta:
I
Corre em mim
(devastado)
um rio de revolta
e
cicio.
Por nada deste mundo
há de saber-se afogado,
senão por sua sede
e seu desvio!
II
Tudo que edifico
na origem milenar da espera
é poder
do que não pode
e se revela
ad mensuram.
(VIEIRA, Delermando. Os tambores da tempestade. Goiânia: Poligráfica, 2010. p. 23-24.)
Considere o verso extraído do Texto 2:
“Por nada deste mundo
há de saber-se afogado,
senão por sua sede
e seu desvio!"
Para afogar as mágoas, muitos recorrem à ingestão de quantidade excessiva de bebida alcoólica. Esse excesso pode acarretar a famosa ressaca, caracterizada por diversos sintomas, entre os quais a sede. Esta, por sua vez, é explicada pelo fato de o etanol ter alto poder diurético, fazendo que os rins produzam muita urina. A pessoa se desidrata devido à grande quantidade de água eliminada.
Sobre a água e o etanol são feitas afirmações. Assinale a única alternativa correta:
A respeito do ácido propanoico pode-se afirmar:
I. É muito solúvel em água.
II. Apresenta massa molar de 72 g/mol.
III. A combustão completa de 37 g de ácido propanoico gera 66 g de gás carbônico.
IV. Pode ser obtido a partir da oxidação do propanal.
V. A reação com etanol na presença de ácido sulfúrico concentrado resulta no éster etanoato de propila (acetato de propila).
Estão corretas apenas as afirmações
H2SO4 (conc) + NaCl(s) → HCl(g) + NaHSO4 (s)
4 HCl(aq) + MnO2 (s) → MnCl2 (aq) + 2 H2 O(l) + Cl2 (g)
Sobre essas reações foram feitas as seguintes afirmações:
I. As duas reações podem ser classificadas como de oxirredução.
II. O dióxido de manganês (MnO2 ) atua como agente oxidante na segunda reação.
III. Na segunda reação, nem todos os átomos de cloro presentes no HCl sofrem variação de Nox.
IV. O ácido clorídrico (HCl) é considerado um ácido fraco.
Estão corretas apenas as afirmações
Em um caderno foram encontradas algumas afirmações a respeito desse diagrama.
I. O calor de formação da água líquida no estado padrão é de 971 kJ/mol.
II. A combustão de um mol de gás hidrogênio gerando água no estado líquido libera 286 kJ.
III. A energia de ligação O=O é de 498 kJ/mol. IV. A vaporização de um mol de água libera 44 kJ.
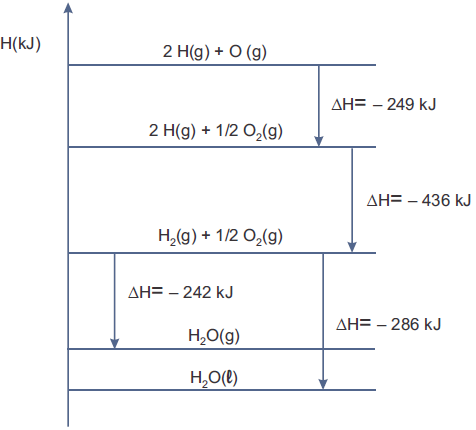
Estão corretas apenas as afirmações
I. A concentração de cátions H+ é 1000 vezes maior na solução de pH 9 em relação à solução de pH 12.
II. A concentração de ânions OH- na solução de pH 9 é 75% da concentração desse mesmo ânion na solução de pH 12.
III. Os gases borbulhados podem ser CH4 ou NH3 .
IV. Os gases borbulhados podem ser CO2 ou SO2 .
Estão corretas apenas as afirmações
2 NaHCO3 (s) → Na2CO3 (s) + H 2O (g) + CO2 (g)
Considere o preparo de dois bolos com as mesmas quantidades de ingredientes e sob as mesmas condições, diferindo apenas na temperatura do forno: um foi cozido a 160 oC e o outro a 220 oC. Em ambos, todo o fermento foi consumido.
O gráfico que relaciona a massa de CO2 formada em função do tempo de cozimento, em cada uma dessas temperaturas de preparo, está apresentado em:
Em um experimento, foi analisado o efeito do número de átomos de carbono sobre a solubilidade de alcoóis em água, bem como sobre a quiralidade das moléculas desses alcoóis. Todas as moléculas de alcoóis testadas tinham número de átomos de carbono variando de 2 a 5, e cadeias carbônicas abertas e não ramificadas.
Dentre os alcoóis utilizados contendo um centro quiral, aquele de maior solubilidade em água possui fórmula estrutural correspondente a:
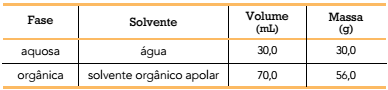
Para diferenciar as duas fases, originariamente incolores, é adicionado ao óleo um corante azul de natureza iônica, que se dissolve apenas na fase em que o solvente apresenta maior afinidade pelo corante. Essa adição não altera as massas e volumes das fases líquidas.
As duas fases líquidas do óleo bifásico podem ser representadas pelo seguinte esquema:
O suco gástrico contém um ácido, produzido pelas células da parede do estômago, que desempenha papel fundamental para a eficiência do processo digestório no ser humano.
O ânion do ácido produzido no estômago corresponde ao elemento químico pertencente ao grupo 17 e ao terceiro período da tabela de classificação periódica.
Esse ácido é denominado:
Combustível produzido com etanol e óleos vegetais está pronto para abastecer ônibus e caminhões
Se tudo correr bem, dentro de dois anos os veículos brasileiros movidos a óleo diesel - caminhões, ônibus,
tratores e locomotivas - estarão rodando com um percentual de biodiesel no tanque. Um dos candidatos a esse novo
combustível foi desenvolvido por meio da reação química de óleos vegetais com etanol, o álcool extraído da cana-de-
açúcar, nos laboratórios da Universidade de São Paulo (USP), em Ribeirão Preto. [...] Com as características de ser
totalmente renovável, produzir menos poluentes que o diesel do petróleo e por já existir uma indústria de produção
de álcool no país, a adoção do biodiesel à base de etanol facilita a incorporação desse tipo de combustível à matriz
energética brasileira. [...]
Apesar da eficiência do processo de conversão [...], o biodiesel brasileiro ainda é mais caro do que o diesel
comum.
Os ensaios ficaram a cargo do engenheiro agrícola Afonso Lopes, professor do Departamento de Engenharia
Rural da Faculdade de Ciências Agrárias e Veterinárias (FCAV). [...] Lopes testou o combustível no trator. [...] Quando
o trator funcionou com 100% de biodiesel, o consumo aumentou, em média, 11%”, conta Lopes.
Eduardo Cesar, Revista Fapesp, Edição 94 – Tecnologia – Dez. 2003. Texto adaptado.
Dados
Óleo diesel: ΔH(combustão) = - 41,0 MJ/kg
Biodiesel: ΔH(combustão) = - 36,9 MJ/kg
Combustível produzido com etanol e óleos vegetais está pronto para abastecer ônibus e caminhões
Se tudo correr bem, dentro de dois anos os veículos brasileiros movidos a óleo diesel - caminhões, ônibus,
tratores e locomotivas - estarão rodando com um percentual de biodiesel no tanque. Um dos candidatos a esse novo
combustível foi desenvolvido por meio da reação química de óleos vegetais com etanol, o álcool extraído da cana-de-
açúcar, nos laboratórios da Universidade de São Paulo (USP), em Ribeirão Preto. [...] Com as características de ser
totalmente renovável, produzir menos poluentes que o diesel do petróleo e por já existir uma indústria de produção
de álcool no país, a adoção do biodiesel à base de etanol facilita a incorporação desse tipo de combustível à matriz
energética brasileira. [...]
Apesar da eficiência do processo de conversão [...], o biodiesel brasileiro ainda é mais caro do que o diesel
comum.
Os ensaios ficaram a cargo do engenheiro agrícola Afonso Lopes, professor do Departamento de Engenharia
Rural da Faculdade de Ciências Agrárias e Veterinárias (FCAV). [...] Lopes testou o combustível no trator. [...] Quando
o trator funcionou com 100% de biodiesel, o consumo aumentou, em média, 11%”, conta Lopes.
Eduardo Cesar, Revista Fapesp, Edição 94 – Tecnologia – Dez. 2003. Texto adaptado.
Combustível produzido com etanol e óleos vegetais está pronto para abastecer ônibus e caminhões
Se tudo correr bem, dentro de dois anos os veículos brasileiros movidos a óleo diesel - caminhões, ônibus,
tratores e locomotivas - estarão rodando com um percentual de biodiesel no tanque. Um dos candidatos a esse novo
combustível foi desenvolvido por meio da reação química de óleos vegetais com etanol, o álcool extraído da cana-de-
açúcar, nos laboratórios da Universidade de São Paulo (USP), em Ribeirão Preto. [...] Com as características de ser
totalmente renovável, produzir menos poluentes que o diesel do petróleo e por já existir uma indústria de produção
de álcool no país, a adoção do biodiesel à base de etanol facilita a incorporação desse tipo de combustível à matriz
energética brasileira. [...]
Apesar da eficiência do processo de conversão [...], o biodiesel brasileiro ainda é mais caro do que o diesel
comum.
Os ensaios ficaram a cargo do engenheiro agrícola Afonso Lopes, professor do Departamento de Engenharia
Rural da Faculdade de Ciências Agrárias e Veterinárias (FCAV). [...] Lopes testou o combustível no trator. [...] Quando
o trator funcionou com 100% de biodiesel, o consumo aumentou, em média, 11%”, conta Lopes.
Eduardo Cesar, Revista Fapesp, Edição 94 – Tecnologia – Dez. 2003. Texto adaptado.
