Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
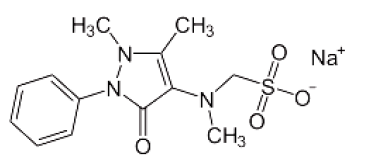
Com relação à estrutura apresentada, percebe-se que
CLASSIFICAÇÃO: Água mineral Fluoretada e Vanádica CARACTERÍSTICAS FÍSICO-QUÍMICA
pH a 25 °C ........................................................................................................... 6,79 Temperatura da água na fonte ....................................................................... 21,3 °C Condutividade elétrica a 25 °C .................................................................. 296 uS/cm Resíduo de evaporação a 180 °C, calculado ........................................... 245,24 mg/L Radioatividade na fonte a 20 °C e 760 mmHg ........................................ 0,97 maches
COMPOSIÇÃO QUÍMICA (mg/L)
Bicarbonato ..................................................................................................... 158,79 Cálcio ............................................................................................................... 31,426 Sódio ................................................................................................................ 15,583 Magnésio .......................................................................................................... 13,193 Cloreto ................................................................................................................. 8,43 Potássio ............................................................................................................. 0,438 Fluoreto ............................................................................................................... 0,14 Estrôncio ............................................................................................................ 0,111 Vanádio .............................................................................................................. 0,026
Considerando as informações apresentadas, qual é a concentração em mmol/L do único ânion oxigenado apresentado na tabela?
Cu(s) + 4 HNO3(aq) ➔ Cu(NO3)2(aq) + 2 NO2(g) + 2 H2O(l)
De acordo com a equação química apresentada, qual deve ser o volume aproximado, em litros, de gás formado nas CNTP, considerando que a amostra metálica de cobre de 200 g apresentava 18 % de impurezas em sua composição. - Considere volume molar nas CNTP = 22,4 L. mol−¹
Instruções: Leia atentamente o texto abaixo para responder a
questão.
Banana, a fruta mais consumida e perigosa do mundo


(Adaptado de Sergio Augusto, O Estado de S. Paulo, 26/04/2008)
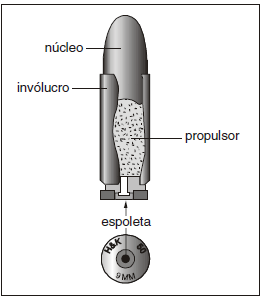
Para um núcleo de 100 g, o número mínimo de átomos de antimônio é, aproximadamente,
Dados: Massas molares (g . mol−1): Pb = 207,2 Sb = 121,8 Constante de Avogadro = 6,0 × 1023 mol−1
Instruções: Leia atentamente o texto abaixo para responder a
questão.
Banana, a fruta mais consumida e perigosa do mundo


(Adaptado de Sergio Augusto, O Estado de S. Paulo, 26/04/2008)
Instruções: Leia atentamente o texto abaixo para responder a
questão.
Banana, a fruta mais consumida e perigosa do mundo


(Adaptado de Sergio Augusto, O Estado de S. Paulo, 26/04/2008)
I. zinco. II. magnésio. III. cobre. IV. estanho.
É correto o que se afirma SOMENTE em
Dados: Potenciais-padrão de eletrodo (volt): Mg2+ + 2e− → Mg (s) −2,363 Zn2+ + 2e− → Zn (s) −0,763 Fe2+ + 2e− → Fe (s) −0,440 Sn2+ + 2e− → Sn (s) −0,336 Cu2+ + 2e− → Cu (s) +0,337
Instruções: Leia atentamente o texto abaixo para responder a
questão.
Banana, a fruta mais consumida e perigosa do mundo


(Adaptado de Sergio Augusto, O Estado de S. Paulo, 26/04/2008)
Dado: Massa molar da sacarose = 342 g . mol−1
Instruções: Leia atentamente o texto abaixo para responder a
questão.
Banana, a fruta mais consumida e perigosa do mundo


(Adaptado de Sergio Augusto, O Estado de S. Paulo, 26/04/2008)
Dados: Massa molar do K = 39,1 g . mol−1 Constante de Avogadro = 6,0 × 1023 mol−1
O ácido clorogênico é uma substância natural que está presente em diversas plantas.
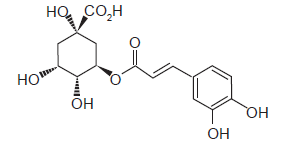
Na estrutura química do ácido clorogênico, que está representada acima, quantos átomos de carbono com hibridização
sp3
existem?
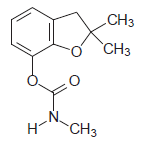
A fórmula molecular do carbofurano é
PbSO4(s)
 Pb2+
(aq) + SO4
2- (aq) ; Kps
= 2 × 10-8
(mol L-1
)
2
Pb2+
(aq) + SO4
2- (aq) ; Kps
= 2 × 10-8
(mol L-1
)
2
A concentração mínima, em mol L-1 , de íons SO4 2- que deve ser mantida em solução para que tal diminuição ocorra é
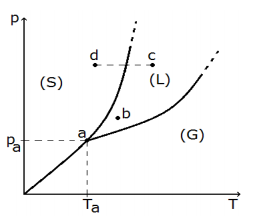
As regiões de existência de cada fase estão identificadas por (S), (L) e (G), e os pontos a, b, c e d indicam quatro estados distintos de (p,T). Considere as seguintes afirmações.
I - A substância não pode sublimar, se submetida a pressões constantes maiores do que pa.
II - A substância, se estiver no estado b, pode ser vaporizada por transformações isotérmicas ou isobáricas.
III- A mudança de estado c
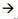 d é isobárica e
conhecida como solidificação.
Quais estão corretas?
d é isobárica e
conhecida como solidificação.
Quais estão corretas? Assinale a alternativa que melhor representa a variação da pressão (p) exercida pelo gás, em função da variação do volume (V) do recipiente.
Um volume de 100 mL de uma solução aquosa de NaC 0,100 mol L-1 foi misturado com 50 mL de solução de Pb(NO3)2 0,050 mol L-1. A alternativa que indica mais proximamente a massa, em g, de PbCℓ2(s) produzida, assumindo reação com 100% de rendimento é a
Dado
M PbCℓ2
= 278 g mol-1
Considere uma pilha que consiste em uma placa de cobre imersa em uma solução de Cu(NO3)2 1,0 mol L-1 e um fio de prata imerso uma solução de AgNO3 1,0 mol L-1. Admita que um fio metálico una a placa de cobre ao fio de prata e que há uma ponte salina imersa nas soluções.
Sobre essa pilha, verifica-se que
Dados
Eo
Cu2+
(aq) /Cuo
= + 0,34 V
Eo
Ag+
(aq) /Ago
= + 0,80 V
 têm-se mostrado
promissoras devido ao potencial terapêutico comprovado
em cobaias. Sobre um átomo eletricamente neutro do elemento químico ouro, verifica-se que no núcleo há
têm-se mostrado
promissoras devido ao potencial terapêutico comprovado
em cobaias. Sobre um átomo eletricamente neutro do elemento químico ouro, verifica-se que no núcleo há A estrutura química de uma substância orgânica é representada a seguir:
A cadeia carbônica dessa substância se classifica como
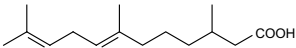
A estrutura química representada a seguir é de uma substância antifúngica muito utilizada em plantações de laranja e maçã, entre outras.
Na estrutura química dessa substância, estão as funções
orgânicas