Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Têm-se duas substâncias X e Y, sendo a primeira orgânica e a segunda inorgânica. Com relação a X e Y, afirma-se que:
I a maioria das reações de X são mais rápidas do que as de Y;
II X é solúvel em solventes apolares e Y em solventes polares;
III X provavelmente tem isômeros; Y não os tem.
Assinale a alternativa que apresenta as afirmações
corretas em relação a X e Y.
H2(g) + I2(g)
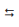 2HI(g)
2HI(g)
Que alterações farão variar a constante de equilíbrio da reação entre o H2(g) e o I2(g)?
I adição de um catalisador II aumento da pressão (temperatura constante) III aumento da concentração dos reagentes IV aumento da temperatura V aumento da concentração dos produtos
(NH4 )2 SO4(s) --------> NH4 +(aq) + SO4 = (aq).
Supondo que se dissolvem 1,32 g de sulfato de amônio em 0,500 litros de água, pode-se afirmar que as concentrações em mols.L-1 de NH4 +(aq) e de SO4 = (aq), respectivamente, são
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

A vitamina D é muitas vezes conhecida como a vitamina do sol, contudo, somente a vitamina D3 (colecalciferol) é produzida por meio da síntese natural da luz solar sobre a pele. A vitamina D3 é considerada a forma mais benéfica ao corpo, pois regula o nível de cálcio e fósforo no sangue, o que é vital para o desenvolvimento e o crescimento dos ossos. Ela reduz o risco de câncer de próstata, câncer de mama e câncer de cólon.
Colecalciferol
Com relação à estrutura da vitamina D3, assinale a
afirmação correta.
(www.inovacaotecnologica.com.br. Adaptado.)
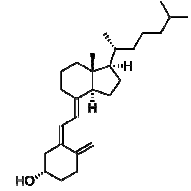
Na representação do polímero I, observa-se a unidade da cadeia polimérica que se repete n vezes para a formação da macromolécula. Essa unidade polimérica apresenta um grupo funcional classificado como
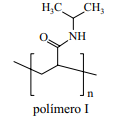
(Pesquisa Fapesp, janeiro de 2013. Adaptado.)
As figuras permitem observar diferenças no espocar de um champanhe: a 18 ºC, logo no início, observa-se que o volume de CO2 disperso na nuvem gasosa – não detectável na faixa da luz visível, mas sim do infravermelho – é muito maior do que quando a temperatura é de 4 ºC. Numa festa de fim de ano, os estudantes utilizaram os dados desse experimento para demonstrar a lei que diz:


A figura mostra um processo de extração da vanilina a partir de vagens de orquídea espalhadas sobre bandejas perfuradas, em tanques de aço, usando etanol (60% v/v) como solvente. Em geral, a extração dura duas semanas.
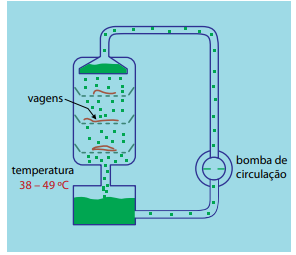
(www.greener-industry.org.uk. Adaptado.)
De acordo com o que mostra a figura, a extração da vanilina a partir de fontes naturais se dá por
Cada estudante recebeu um recipiente contendo 800 mL de água destilada com algumas gotas do indicador de pH alaranjado de metila e soluções de HCl e NaOH em diversas concentrações.
Cada estudante deveria jogar apenas uma vez dois dados, um amarelo e um vermelho, ambos contendo os números de 1 a 6.
• Ao jogar o dado vermelho, o estudante deveria adicionar ao recipiente 100 mL de solução do ácido clorídrico na concentração 10−n mol/L,sendo n o número marcado no dado (por exemplo, se saísse o número 1 no dado, a solução seria de 10−1 mol/L; se saísse 6, a solução seria de 10−6 mol/L). • Ao jogar o dado amarelo, o estudante deveria executar o mesmo procedimento, mas substituindo o ácido por NaOH, totalizando assim 1,0 L de solução. • O estudante deveria observar a cor da solução ao final do experimento.
A professora mostrou a tabela com alguns valores de pH resultantes conforme os números tirados nos dados. Ela pediu, então, aos estudantes que utilizassem seus conhecimentos e a tabela para prever em quais combinações de dados a cor final do indicador seria vermelha.
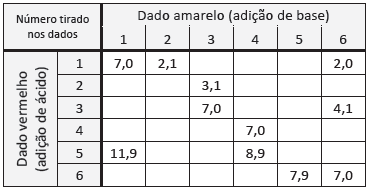
A probabilidade de, após realizar o procedimento descrito, a solução final preparada por um estudante ser vermelha é de:
Note e adote:
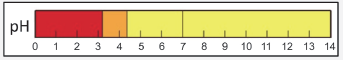
Considere a seguinte relação entre pH do meio e coloração do indicador alaranjado de metila:
Menor que 3,3 3,3 a 4,4 Maior que 4,4 Vermelho Laranja Amarelo
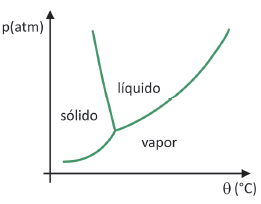
Apesar de ser um processo que requer, industrialmente, uso de certa tecnologia, existem evidências de que os povos pré‐ colombianos que viviam nas regiões mais altas dos Andes conseguiam liofilizar alimentos, possibilitando estocá‐los por mais tempo. Assinale a alternativa que explica como ocorria o processo de liofilização natural:
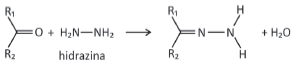
pode ser explorada para a quantificação de compostos cetônicos gerados, por exemplo, pela respiração humana. Para tanto, uma hidrazina específica, a 2,4‐dinitrofenilhidrazina, é utilizada como reagente, gerando um produto que possui cor intensa.
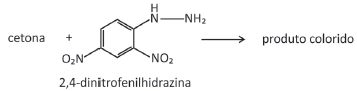
Considere que a 2,4‐dinitrofenilhidrazina seja utilizada para quantificar o seguinte composto:
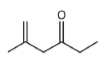
Nesse caso, a estrutura do composto colorido formado será:
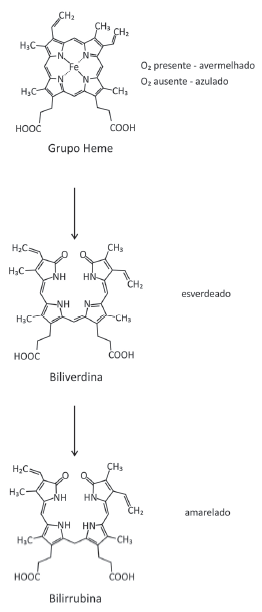
Com base nas informações e nas representações, é correto afirmar: