Questões de Vestibular Sobre química
Foram encontradas 6.605 questões

A partir da polimerização de determinado monômero,
realizada em solução com duas diferentes condições reacionais,
chegou-se a polímeros com diferentes distribuições de
massas molares, conforme ilustrado na figura acima. Ao final
dos procedimentos de síntese, as duas soluções obtidas —
uma contendo o polímero A (solução I) e outra, o polímero B
(solução II) — tinham concentrações iguais, em g/L.
Com base nessa situação e considerando que os comportamentos das soluções sejam ideais e que os polímeros sejam estáveis na temperatura de ebulição do solvente empregado em suas sínteses, julgue o item e faça o que se pede no item, que é do tipo C.
A respeito das soluções preparadas, assinale a opção correta.
A solução I apresenta pressão osmótica superior à da
solução II.

A partir da polimerização de determinado monômero,
realizada em solução com duas diferentes condições reacionais,
chegou-se a polímeros com diferentes distribuições de
massas molares, conforme ilustrado na figura acima. Ao final
dos procedimentos de síntese, as duas soluções obtidas —
uma contendo o polímero A (solução I) e outra, o polímero B
(solução II) — tinham concentrações iguais, em g/L.
Com base nessa situação e considerando que os comportamentos das soluções sejam ideais e que os polímeros sejam estáveis na temperatura de ebulição do solvente empregado em suas sínteses, julgue o item.
A separação dos polímeros a partir da solução obtida ao final
de cada reação pode ser realizada pelo processo de destilação.

A partir da polimerização de determinado monômero,
realizada em solução com duas diferentes condições reacionais,
chegou-se a polímeros com diferentes distribuições de
massas molares, conforme ilustrado na figura acima. Ao final
dos procedimentos de síntese, as duas soluções obtidas —
uma contendo o polímero A (solução I) e outra, o polímero B
(solução II) — tinham concentrações iguais, em g/L.
Com base nessa situação e considerando que os comportamentos das soluções sejam ideais e que os polímeros sejam estáveis na temperatura de ebulição do solvente empregado em suas sínteses, julgue o item.
O ponto de fusão do polímero A é mais elevado que o do
polímero B.
Nos polímeros condutores, a flexibilidade e a facilidade de processamento típicas dos polímeros são combinadas com propriedades ópticas e eletrônicas de metais e semicondutores. Nesse tipo de polímero, a presença de ligações duplas alternadas faz que os elétrons π estejam deslocalizados devido à ressonância, efeito responsável pela condutividade elétrica do material. O poliacetileno, polímero de adição do acetileno (etino), foi o primeiro polímero condutor sintetizado.

Considerando o texto e a estrutura do polietileno apresentados acima, julgue o próximo item.
Na água, a solubilidade do poliacetileno é elevada porque esse
polímero forma facilmente ligações de hidrogênio com esse
solvente.
Nos polímeros condutores, a flexibilidade e a facilidade de processamento típicas dos polímeros são combinadas com propriedades ópticas e eletrônicas de metais e semicondutores. Nesse tipo de polímero, a presença de ligações duplas alternadas faz que os elétrons π estejam deslocalizados devido à ressonância, efeito responsável pela condutividade elétrica do material. O poliacetileno, polímero de adição do acetileno (etino), foi o primeiro polímero condutor sintetizado.

Considerando o texto e a estrutura do polietileno apresentados acima, julgue o próximo item.
Se for feita polimerização por adição do 1,3-butadieno, será
obtido um polímero condutor.

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item que é do tipo C.
Suponha que uma amostra de água esteja contaminada pela dissolução de uma pequena quantidade de CaTiO3. Nesse caso, o composto que possibilitaria a neutralização dessa amostra de água contaminada é
H2SO4.

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
No CaTiO3, o número de oxidação do Ti é +2.

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
Se a for a medida da aresta do cubo, então a medida da aresta
do octaedro será 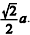

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
Se um plano contém alguma face do octaedro, então esse plano
contém um único vértice do cubo.

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
O número de átomos de cálcio presentes em 27,2 g de CaTiO3
é 1,2 × 1023.

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
O AlCl3 atua como um ácido de Lewis em reações de
alquilação de Friedel-Crafts.

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
Na presença do AlCl3, a reação se processa por um caminho
que envolve menor energia de ativação quando comparada à
reação não catalisada.

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
Os valores de entalpias de formação dos compostos envolvidos na reação apresentada abaixo permitem concluir que a reação é endotérmica
C6H6(l) + CH3Cl(g) → C6H5CH3(l) + HCl(g)

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
A síntese do timol a partir do fenol pode ser convenientemente realizada por meio da rota reacional mostrada abaixo.
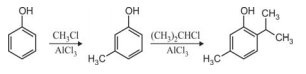

A figura acima ilustra a alquilação de Friedel-Crafts, uma reação de substituição eletrolítica que ocorre entre um anel aromático e um cloreto de alquila. O AlCl3 é o catalisador mais usualmente empregado nesse tipo de reação. Conforme mostrado na reação a seguir, o AlCl3 liga-se ao cloro do cloreto de alquila e libera um carbocátion, que será o responsável pelo ataque eletrofílico ao anel aromático.

Considerando, além das informações do texto e da tabela acima, que as alquilações de Friedel-Crafts sejam de ordem um com relação ao composto aromático e de ordem um com relação ao cloreto de alquila, e que o grupo –OH seja um orientador orto/para dirigente, julgue o item subsequente.
Considere que a alquilação de Friedel-Crafts seja realizada na
presença de um solvente. Se forem dobradas as concentrações
do composto aromático e do cloreto de alquila, a velocidade da
reação será multiplicada por quatro.
Ao longo dos anos, diversas descobertas levaram ao crescente aperfeiçoamento dos modelos atômicos. Em relação a esse assunto, faça o que se pede no item, que é do tipo C.
.
Assinale a opção correspondente à figura que melhor ilustra o modelo atômico de Thomson, que sucedeu o modelo de Dalton.

Ao longo dos anos, diversas descobertas levaram ao crescente aperfeiçoamento dos modelos atômicos. Em relação a esse assunto, julgue o item.
Apesar de inúmeras falhas, o modelo atômico de Dalton foi
capaz de explicar o princípio da conservação de massa, de
Lavoisier.
.
Considerando a figura acima, que representa a molécula de desoxirribose, unidade repetitiva presente na estrutura do DNA, julgue o item a seguir.
Uma molécula de desoxirribose pode sofrer reação de
saponificação para formar sais de ácidos carboxílicos.
Considerando a figura acima, que representa a molécula de desoxirribose, unidade repetitiva presente na estrutura do DNA, julgue o item a seguir.
Na molécula de desoxirribose, os átomos de hidrogênio com
maior acidez são aqueles que se ligam diretamente a um átomo
de carbono.
Considerando a figura acima, que representa a molécula de desoxirribose, unidade repetitiva presente na estrutura do DNA, julgue o item a seguir.
As ligações de hidrogênio entre as bases nitrogenadas são
responsáveis pela manutenção da estrutura em dupla hélice do
DNA.
