Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Tem-se uma solução de hidróxido de amônio (Kb = 1.7x10-5) que apresenta um pH igual a 10.00.
A molaridade desta solução é:
O bisfenol A é uma substância empregada na síntese de policarbonato e resinas epóxi, com aplicações que vão desde computadores e eletrodomésticos até revestimentos para latas de alimentos e bebidas. Estudos apontam que a substância, por possuir similaridade com um hormônio feminino da tireoide, atua como um interferente endócrino. No Brasil, desde 2012 é proibida a venda de mamadeiras ou outros utensílios que contenham bisfenol A. O 2,2-difenilpropano, de estrutura similar ao bisfenol A, é um hidrocarboneto com grau de toxicidade ainda maior que o bisfenol A. As fórmulas estruturais dessas substâncias são apresentadas a seguir.
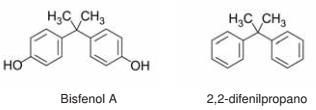
Com base nas propriedades físico-químicas dessas substâncias, considere as afirmativas a seguir.
I. A solubilidade do bisfenol A em solução alcalina é maior que em água pura.
II. Ligações de hidrogênio e interações π − π são forças intermoleculares que atuam entre moléculas de bisfenol A.
III. A solubilidade do 2,2-difenilpropano em água é maior do que em hexano.
IV. O ponto de fusão do 2,2-difenilpropano é maior que do bisfenol A.
Assinale a alternativa correta.
A crescente contaminação ambiental pelas indústrias tem sido combatida com o desenvolvimento de novas técnicas de tratamento de efluentes tóxicos. O processo Fenton, conforme reação 1 a seguir, é um dos procedimentos utilizados no tratamento de efluentes orgânicos.
Reação 1: Fe2+(aq) + H2O2(aq) → Fe3+(aq) + OH−(aq) + OH• (aq) k = 76 (mol L−1) −1 s−1
Na reação 1, há a formação de OH• (radical hidroxila) com potencial oxidante superior ao H2O2. Assim, a eficiência deste processo se dá pela produção de OH•, capaz de oxidar uma ampla variedade de compostos orgânicos gerando CO2, H2O e íons inorgânicos provenientes de heteroátomos. Além da reação 1, é possível ocorrer a reação 2, em que há a formação de HO2•, que, por sua vez, é um oxidante menos reativo que o OH•, diminuindo assim a eficiência do processo Fenton.
Reação 2: H2O2(aq) + OH• (aq) → HO2•(aq) + H2O(l) k = 2,7 x 107 (mol L−1) −1 s−1
Considerando as reações químicas envolvidas e os fatores que podem influenciar na eficiência do processo e com base nos conhecimentos sobre equilíbrio químico cinética química e eletroquímica, assinale a alternativa correta.
A contaminação de ecossistemas em função do crescimento populacional e da industrialização tem sido cada vez maior ao longo dos anos, mesmo com o advento de tecnologias voltadas à descontaminação ambiental. Um dos efeitos deletérios ao ambiente é a elevada acidez da chuva e de solos. A figura a seguir mostra o efeito que a acidez do solo causa na velocidade de lixiviação de íons Cd2+.
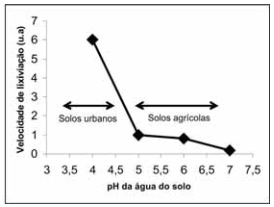
Dados: Kps para Cd(OH)2(s) = 2,5 x 10−14
Quanto maior a velocidade de lixiviação, maior o transporte de Cd2+ para os lagos por meio da corrente superficial ou subsuperficial, transferido para os aquíferos ou absorvido pela vegetação, com efeitos tóxicos.
Com base na figura e nos conhecimentos sobre solubilidade de metais e equilíbrio químico, é correto afirmar que
a lixiviação de cádmio
A hipoglicemia é caracterizada por uma concentração de glicose abaixo de 0,70 g L−1 no sangue. O quadro de hipoglicemia em situações extremas pode levar a crises convulsivas, perda de consciência e morte do indivíduo, se não for revertido a tempo. Entretanto, na maioria das vezes, o indivíduo, percebendo os sinais de hipoglicemia, consegue reverter este déficit, consumindo de 15 a 20 gramas de carboidratos, preferencialmente simples, como a glicose.
A metabolização da glicose, C6H12O6, durante a respiração, pode ser representada pela equação química de combustão:
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l)
No quadro a seguir, são informadas reações químicas e seus respectivos calores de formação a 25 °C e 1 atm:

Sabendo que a Massa Molar (MM) da glicose é igual a 180,0 g mol−1, determine a quantidade aproximada de energia
liberada em kJ mol−1 no estado padrão, ΔHr°, na combustão da glicose, consumida em 350 mL de refrigerante
do tipo Cola, o qual possui, em sua composição, 35 g de glicose.
Em 2017, a ANVISA aprovou a administração de um medicamento antirretroviral composto pela combinação das substâncias entricitabina (FTC) e fumarato (molécula contendo ácido carboxílico como função orgânica) de tenofovir desoproxila (TDF) para pessoas com alto risco de infecção pelo vírus HIV. O medicamento apresenta Profilaxia Pré-Exposição (PrEP), ou seja, evita que uma pessoa que não tem HIV adquira a infecção quando se expõe ao vírus.
As estruturas químicas da FTC e do TDF são apresentada
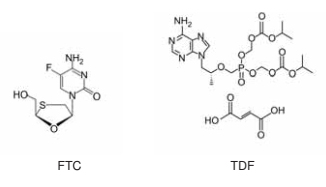
Dados:
Massa molar da FTC = 247,24 g mol−1
Massa molar do TDF = 635,52 g mol−1
Sabe-se que a solubilidade em água a 25 °C da FTC é 13,4 mg L−1 e do TDF é 112,0 mg mL−1 e que a constante de ionização da FTC é de 5,12 x 10−15, cujo hidrogênio ácido é aquele pertencente à hidroxila.
Com base nas estruturas químicas e nas informações apresentadas sobre as moléculas, assinale a alternativa
correta.
Os cosméticos, como batons e rímeis, buscam realçar o encanto da beleza. Porém, o uso desses produtos pode, também, causar desencantamento em função dos constituintes químicos tóxicos que possuem. Em batons, pode haver presença de cádmio, chumbo, arsênio e alumínio. A FDA (Food and Drug Administration) e a ANVISA (Agência Nacional de Vigilância Sanitária) preconizam limites máximos de metais apenas para corantes orgânicos artificiais utilizados como matéria-prima na fabricação de cosméticos.
Considerando que um determinado batom possua concentração de chumbo igual a 1,0 mg Kg−1 e que a estimativa máxima de utilização deste cosmético ao longo do dia seja de 100 mg, assinale a alternativa que representa, correta e aproximadamente, o número de átomos de chumbo em contato com os lábios ao longo de um dia.
Dados:
Massa molar de chumbo = 207 g mol−1
Constante de Avogadro = 6,0 x 1023 mol−1
O acetato de etila (CH3COOCH2CH3) é um éster simples, usado, no passado, como antiespasmódico e hoje como solvente industrial e removedor de esmalte de unha. A acetona (CH3(CO)CH3) também é usada como removedor de esmaltes, mas devido a sua elevada solubilidade em água, quando em contato com a pele, pode desidratá-la. Sabe-se que estes solventes possuem cheiros parecidos, tornando difícil a identificação pelo olfato.
Considerando um frasco contendo acetato de etila e acetona em quantidades equimolares, assinale a alternativa que apresenta, corretamente, o procedimento para a separação da mistura.
Dados:
Ponto de ebulição do acetato de etila a 1 atm =77,1 °C e densidade = 902 Kg/m3
Ponto de ebulição da acetona a 1 atm = 56,0 °C e densidade = 784 Kg/m3
Medicamento é um produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico. A química orgânica é fundamental para o desenvolvimento de novos fármacos e o crescimento da indústria farmacêutica.
Dois dos princípios ativos de medicamentos mais
utilizados pelos brasileiros são ilustrados a seguir:
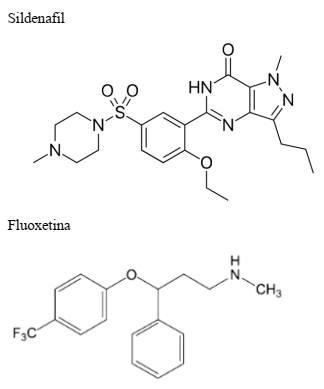
Em relação aos compostos apresentados, assinale a
alternativa CORRETA:
Nicotina, um dos principais constituintes do cigarro, é um alcaloide, encontrado nas folhas do tabaco (Nicotiana tabacum), planta originária das Américas, sendo a molécula responsável pela dependência.
Sua composição porcentual, em massa, é 74,1% de carbono, 8,6% de hidrogênio e 17,3% de nitrogênio.
Assinale a alternativa que indica CORRETAMENTE a fórmula mínima da nicotina.
Uma fábrica de sucos realizou analises físico-químicas em um laboratório de controle de qualidade do suco de limão com manjericão e do suco de tomate e obteve os seguintes resultados:
• Suco de limão com manjericão: pH = 2,3.
• Suco de tomate: pH = 4,3.
Dados:
log 5= 0,7
Com base nos resultados, é CORRETO afirmar que:
Óleos essenciais são compostos aromáticos voláteis extraídos de plantas que são utilizados na aromaterapia devido às suas propriedades analgésicas, relaxantes e estimulantes.
As fórmulas estruturais de alguns componentes dos óleos essenciais são apresentadas a seguir:
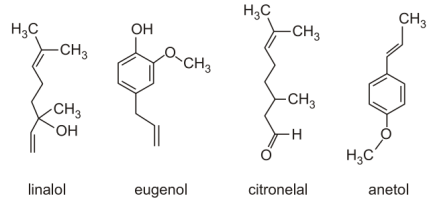
Considerando as fórmulas apresentadas, assinale a alternativa CORRETA:
Vinagre é uma mistura homogênea cujo principal constituinte é o ácido acético. Um estudante de química analisou uma amostra de uma garrafa de 500mL de vinagre de maçã, em que, no rótulo, há a informação de que o teor do ácido acético presente na solução é de 4,2% m/v.
Considerando que o ácido acético é o único composto de caráter ácido do vinagre, analise as proposições sugeridas pelo estudante após as análises.
I- A molaridade do ácido acético na amostra analisada é 0,7mol/L.
II- Ao titular 20mL desse vinagre com hidróxido de sódio 1mol/L, foram gastos 50mL da base.
III- Uma cozinheira que utiliza 6,3g de vinagre por dia, durante 30 dias, irá utilizar 9 garrafas.
Está(ão) CORRETA(S) a(s) afirmativa(s):
Observe o aparelho esquematizado a seguir:
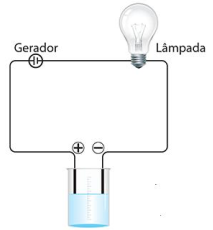
Assinale a alternativa que indica CORRETAMENTE
a substância que, quando adicionada em quantidade
adequada à água, poderia provocar um brilho muito
intenso na lâmpada.
Nas prateleiras de supermercados é comum encontrarmos alimentos desidratados, isto é, isentos de água em sua composição. Para desidratar alimentos, é utilizado o processo de liofilização que consiste em se congelar o alimento à temperatura de -197°C e depois submeter o alimento congelado a pressões muito baixas. Na temperatura de -197°C, a água do alimento encontrase na fase sólida e, com o abaixamento de pressão, passa diretamente para a fase de vapor, sendo então eliminada.
Assinale a afirmação CORRETA:
Algumas substâncias de uso cotidiano são conhecidas por nomes populares desprovidos de qualquer regra de nomenclatura. Assim, temos, por exemplo, sublimado corrosivo (HgCl2 ), cal viva (CaO), potassa cáustica (KOH) e espírito de sal (HCl).
O sublimado corrosivo, a cal viva, a potassa cáustica e o espírito de sal pertencem, respectivamente, às funções:
A glicose, importante açúcar na alimentação de muitos seres vivos, possui fórmula igual a C6 H12O6 .
Sobre a glicose, é possível AFIRMAR que:
Um grupo de alunos do curso de Química, ao entrar no laboratório para uma atividade, deparou-se com alguns recipientes não rotulados, embora todos contivessem uma substância líquida e incolor.
Considerando as substâncias, os acadêmicos determinaram as seguintes propriedades para reconhecimento: 1) massa, 2) volume, 3) ponto de ebulição, 4) densidade.
Com base nestas informações, indique quais propriedades possibilitaram aos acadêmicos a identificação das substâncias:
A água sozinha não consegue remover a gordura dos materiais. Para remover as sujeiras, muitas vezes, necessitamos fazer uso dos sabões. Esses compostos apresentam cadeias carbônicas longas, com uma parte apolar e outra parte polar. Essa qualidade é fundamental para que a limpeza seja efetiva. Isso porque, durante o processo de limpeza de um objeto gorduroso, utilizando-se sabão e água, as partículas de gordura são envolvidas pelas partes apolares das moléculas do sabão. Este, por sua vez, também é capaz de se unir às moléculas de água (a interação ocorre entre a parte polar do sabão e a água). Veja a figura a seguir de um tipo de sabão:
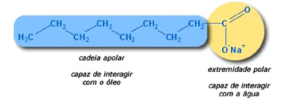
(Fonte:http://mundodaquimica189.blogspot.com.br/2013/04/por-que-o-sabaolimpa.html - Acesso em jan. 2018.)
Forma-se, então, um sistema água-sabão-gordura denominado micela. Essa estrutura, agora solúvel em água, permite que o enxágue retire a gordura do sistema.
A facilitação da limpeza apresentada no texto ocorre porque no
processo