Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
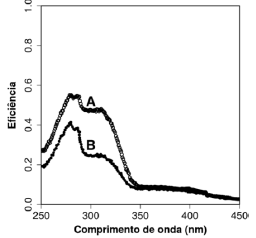
De acordo com essa figura, na faixa de 300 a 320 nm, ao triplicar o tempo de exposição prévia, o protetor apresentou uma eficiência
(Adaptado de Guilherme Profeta, “Da cozinha para o seu carro: cúrcuma utilizada como aditivo de biodiesel”. Cruzeiro do Sul, 10/04/2018.)
Dados de massas molares em g·mol-1: H=1, C=12, O=16.
Considerando as informações dadas e levando em conta que o diesel pode ser caracterizado pela fórmula mínima (CnH2n), é correto afirmar que entre 2008 e 2011 o biodiesel substituiu aproximadamente
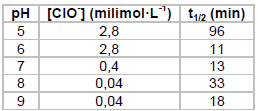
Sendo t1/2 o tempo para a concentração do sarin cair à metade, de acordo com a tabela a reação é mais rápida em
“Só para você ter ideia dos riscos, organizações internacionais de saúde indicam que a ingestão diária de sódio para cada pessoa seja de 2,3 gramas. O glutamato é composto por 21% de sódio e, com certeza, não será o único tempero a ser acrescentado ao seu almoço ou jantar. Além disso, o realçador (glutamato) só conta um terço do nutriente que é encontrado no sal de cozinha.”
Dados de massas molares em g·mol-1: sódio = 23, cloreto = 35,5, glutamato monossódico = 169.
Para tornar a argumentação do artigo mais consistente do ponto de vista químico, você sugeriria a seguinte reescrita dos trechos destacados:
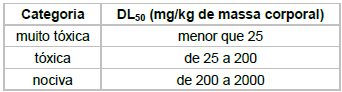
Considerando que a DL50 – dose necessária de uma dada substância para matar 50% de uma população – da cafeína é de 192 mg/kg, no teste realizado a dose aplicada foi cerca de
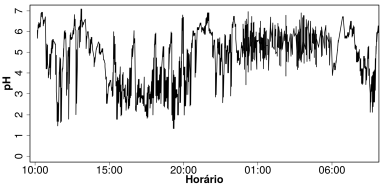
Dados: O pH normal no esôfago mantém-se em torno de 4 e o pH da saliva entre 6,8-7,2.
Assim, episódios de refluxo gastroesofágico acontecem quando o valor de pH medido é
( ) A adição de um catalisador na mistura aumenta o rendimento da reação e promove a formação de outros produtos. ( ) A diminuição do volume ocupado pela mistura gasosa resulta no aumento da velocidade da reação. ( ) A velocidade de decomposição de CH4 é a metade da velocidade de formação de H2O. ( ) A velocidade da reação dobra quando as concentrações de CH4 e O2 forem duplicadas. ( ) A velocidade de formação dos produtos, CO2(g) e H2O(g), da reação de combustão é a mesma.
Assinale a alternativa que contém, de cima para baixo, a sequência correta.
Durante a vida e após a morte, o corpo humano serve de abrigo e alimento para diversos tipos de bactérias que produzem compostos químicos, como a cadaverina e a putrescina. Essas moléculas se formam da decomposição de proteínas, sendo responsáveis, em parte, pelo cheiro de fluidos corporais nos organismos vivos e que também estão associadas ao mau odor característico dos cadáveres no processo de putrefação.
(Adaptado de: <http://qnint.sbq.org.br/novo/index.php?hash= molecula.248>. Acesso em: 22 maio 2017.)
As fórmulas estruturais da cadaverina e da putrescina são apresentadas a seguir.
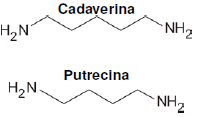
Com base nos conhecimentos sobre funções orgânicas e propriedades de compostos orgânicos, assinale a alternativa que apresenta, corretamente, a característica dessas moléculas.
Diferentes métodos são utilizados por profissionais da área de Ciência Forense para determinar a quanto tempo o indivíduo veio a óbito. Pesquisadores brasileiros reportaram que existe uma relação linear entre a concentração de Fe2+ no corpo vítreo do olho com o intervalo pós-morte. Este método é baseado em uma reação de Fe2+ com orto-fenantrolina como agente cromogênico realizada em um dispositivo de papel, cujo produto da reação apresenta coloração alaranjada. Desta forma, quanto maior o tempo de intervalo pós-morte maior a intensidade de coloração do produto.
(Adaptado de: GARCIA, P.T.; GABRIEL, E.F.M.; PESSÔA, G.S.; SANTOS JUNIOR, J.C.; MOLLO FILHO, P. C.; GUIDUGLI, R.B.F.; HÖEHR, N.F.; ARRUDA, M.A.Z.; COLTRO, W.K.T, Analytica Chimica Acta, v. 974, n.29, p.69-74, 2017).
A equação química da reação de Fe2+ com orto-fenantrolina é apresentada na figura seguir.
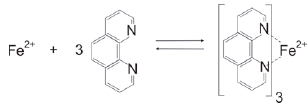
Considerando os conceitos, as definições de ácido e base e a reação química apresentada, assinale a alternativa correta.
A reação química global não balanceada que ocorre durante o funcionamento de baterias de níquel-cádmio pode ser representada pela equação a seguir.
Cd(s)+Ni(OH)3(s) ←→ CdO(s)+Ni(OH)2(s)+H2O(l)
Com base nos conhecimentos sobre células galvânicas e reações de oxidação-redução, considere as afirmativas a seguir.
I. Na bateria de níquel-cádmio, os elétrons fluem do Cd(s) para o Ni(OH)3(s), produzindo energia elétrica por meio de um processo espontâneo. II. O elemento Cd perde elétrons, ocasionando aumento do seu número de oxidação e atuando como agente redutor. III. Na equação balanceada, as espécies Cd(s) e Ni(OH)3(s) apresentam os mesmos coeficientes estequiométricos. IV. Quando a bateria de níquel-cádmio está funcionando, o eletrodo de Ni(OH)3(s) é oxidado, no cátodo, a Ni(OH)2(s).
Assinale a alternativa correta.
Leia o texto a seguir e responda à questão.
O rompimento da barragem da Samarco em novembro de 2015 em Mariana (MG) é um dos maiores desastres do século XXI, considerando o volume de rejeitos despejados no meio ambiente.
Pesquisadores apontam que o resíduo sólido da barragem é constituído por Goethita 60%, Hematita (óxido de ferro) 23%, Quartzo (SiO2) 11,0%, Caulinita Al2Si2O5(OH)4 5,9% e alguns metais, tais como bário, chumbo, crômio, manganês, sódio, cádmio, mercúrio e arsênio.
(Adaptado. Disponível em: <http://agenciabrasil.ebc.com.br/ geral/noticia/2016-01/desastre-em-mariana-e-o-maior-acidentemundial-com-barragens-em-100-anos>. Acesso em: 26 abr 2017.)
Dados: Massas atômicas de: Fe = 56 u; O = 16 u;
Si = 28 u; Al = 27 u; H = 1 u.
Leia o texto a seguir e responda à questão.
O rompimento da barragem da Samarco em novembro de 2015 em Mariana (MG) é um dos maiores desastres do século XXI, considerando o volume de rejeitos despejados no meio ambiente.
Pesquisadores apontam que o resíduo sólido da barragem é constituído por Goethita 60%, Hematita (óxido de ferro) 23%, Quartzo (SiO2) 11,0%, Caulinita Al2Si2O5(OH)4 5,9% e alguns metais, tais como bário, chumbo, crômio, manganês, sódio, cádmio, mercúrio e arsênio.
(Adaptado. Disponível em: <http://agenciabrasil.ebc.com.br/ geral/noticia/2016-01/desastre-em-mariana-e-o-maior-acidentemundial-com-barragens-em-100-anos>. Acesso em: 26 abr 2017.)
Dados: Massas atômicas de: Fe = 56 u; O = 16 u;
Si = 28 u; Al = 27 u; H = 1 u.

Com base nas informações fornecidas, qual dos sais indicados a seguir é o mais eficiente como solução neutralizante?
Os grandes protagonistas na Copa do Mundo de Futebol na Rússia em 2018 foram os polímeros, e não os jogadores. Os polímeros estavam presentes nos uniformes dos jogadores e na bola. O polímero que merece destaque é o poliuretano, utilizado para a impressão térmica dos nomes, números e logos nos uniformes, além de ser utilizado como couro sintético das bolas utilizadas na competição. O poliuretano é obtido a partir da reação entre um isocianato e um poliol, conforme o esquema a seguir:
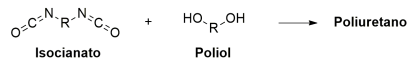
A estrutura química da unidade de repetição desse polímero é:
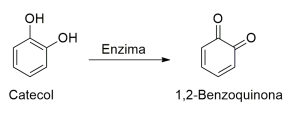
Os abacates, quando cortados e expostos ao ar, começam a escurecer. A reação química responsável por esse fenômeno é catalisada por uma enzima que transforma o catecol em 1,2-benzoquinona, que reage formando um polímero responsável pela cor marrom. Esse é um processo natural e um fator de proteção para a fruta, uma vez que as quinonas são tóxicas para as bactérias.
A respeito do fenômeno descrito acima, considere as seguintes afirmativas:
1. Na estrutura do catecol está presente a função orgânica fenol.
2. O catecol e a 1,2-benzoquinona são isômeros espaciais (enantiômeros).
3. A transformação do catecol em 1,2-benzoquinona é uma reação de oxidação.
4. Todos os átomos de carbono na estrutura da 1,2-benzoquinona possuem hibridização sp3 .
Assinale a alternativa correta
Um certo metal (M), de massa molar igual a 48 g mol-1 , forma um sal de cloreto bastante reativo, que em água sofre hidrólise e produz o óxido desse metal. Verificou-se que na composição de 80 g do óxido, 48 g correspondem a massa apenas do metal.
(Dado: massa molar do oxigênio igual a 16 g mol-1 )
A fórmula mínima desse óxido é:
A nomenclatura de substâncias orgânicas segue um rigoroso conjunto de regras que levam em consideração a função orgânica, a cadeia principal e a posição dos substituintes. Dar o nome oficial a uma substância orgânica muitas vezes não é algo trivial, e o uso desse nome no dia a dia pode ser desencorajador. Por conta disso, muitas substâncias são conhecidas pelos seus nomes populares. Por exemplo, a estrutura orgânica mostrada ao lado lembra a figura de um pinguim, sendo por isso popularmente conhecida como pinguinona.
O nome oficial dessa substância é:
Evidências científicas mostraram que a poluição produzida por navios de guerra durante a Segunda Guerra Mundial interferiram no crescimento das árvores na Noruega. Embarcações da Alemanha ficaram estacionadas boa parte da guerra na costa da Noruega, com a função de impedir uma possível invasão dos inimigos. Para camuflar as embarcações, era produzida uma névoa química, e foi essa névoa artificial a responsável por limitar o crescimento das árvores nesse período. Uma estratégia muito comum para gerar essa névoa artificial era por meio da queima incompleta de óleo combustível, mas também outros métodos foram empregados, como o lançamento na atmosfera de misturas que produziam cloreto de zinco, óxido de titânio ou pentóxido de fósforo.
Esses métodos capazes de produzir névoa artificial se baseiam em reações que:
O níquel é empregado na indústria como catalisador de diversas reações, como na reação de reforma do etileno glicol, que produz hidrogênio a ser utilizado como combustível. O processo ocorre num tempo muito menor quando é utilizado 1 g de níquel em uma forma porosa desse material, em comparação à reação utilizando uma única peça cúbica de 1 g de níquel. Abaixo está esquematizada a equação de reforma do etileno glicol e ao lado uma imagem de microscopia eletrônica de uma amostra de níquel na forma porosa.
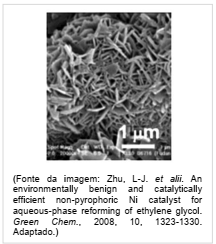
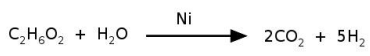
Nas condições mencionadas, a reação de reforma ocorre num tempo menor
quando usado o níquel poroso porque:
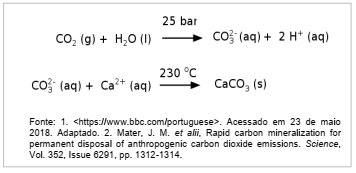
A usina de energia de Hellisheidi, na Islândia, vem testando um novo método para combater o aquecimento global: transformar o gás carbônico (CO2) em pedra. O processo ocorre em duas etapas: primeiro o CO2 é dissolvido em água em altas pressões (25 bar) e depois injetado no solo numa temperatura de 230 °C. A mineralização do gás carbônico ocorre de maneira rápida, devido à reatividade e composição do solo da região, rica em ferro, cálcio e magnésio. As duas etapas da remoção de CO2 estão esquematizadas de maneira simplificada ao lado.
A remoção desse gás da atmosfera ocorre por: