Questões de Vestibular Sobre química
Foram encontradas 6.520 questões
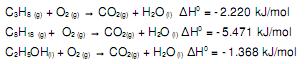
Com base nas fórmulas dos combustíveis e nas equações, considere as afirmativas a seguir:
I) O propano e o noctano são hidrocarbonetos saturados.
II) O noctano é aquele que libera maior quantidade de CO2(g) por mol de combustível
III) A soma dos coeficientes estequiométricos da reação de combustão do etanol é 8.
IV) 50 g de noctano libera maior quantidade de energia do que 100 g de propano.
Estão corretas apenas as afirmativas:
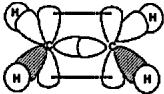
Sobre a representação da figura podemos afirmar que:
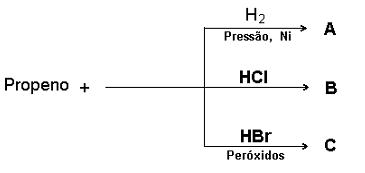
Sobre os processos descritos na figura acima podemos afirmar:

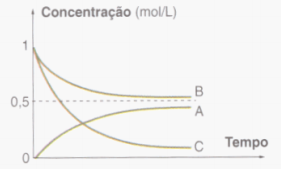
Na análise destes gráficos podemos afirmar:
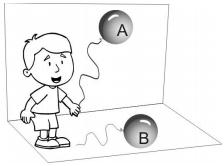
Sabendo-se que o volume molar de um gás ao nível do mar a 25º C é 25 L mol -1 e a densidade do ar atmosférico é 1,2 g L-1 .
Quais são os gases que as bexigas A e B podem conter, respectivamente:
2NO(g) + O2(g) → 2NO2(g)
A tabela a seguir apresenta dados obtidos experimentalmente para determinação da cinética de reação do dióxido de nitrogênio à temperatura de 400o C.
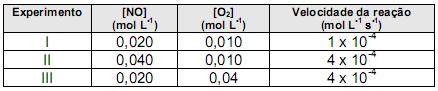
A ordem global da reação é:
Analise os processos a seguir:
I. oxidação de nitrogênio: N2(g) + 2O2(g) →2NO2(g)
II. fotossíntese da glicose: 6CO2(g) + 6H2O(g) → C6H12O6(s) + 6O2(g)
III. evaporação da água de roupas úmidas
IV. dissolução do sal: KNO3(s) → K+ (aq) + NO3 - (aq)
Ocorre aumento de entropia durante os processos

A partir dessas informações e com base nos conhecimentos sobre compostos bioquímicos, é correto afirmar:
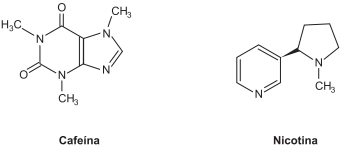
Considerando-se a estrutura da cafeína, estimulante encontrado no café, e a da nicotina, uma das substâncias responsáveis pela dependência associada ao uso de tabaco, é correto afirmar:
De acordo com essas informações, é correto destacar:
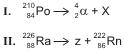
O ano de 2011 foi escolhido pela UNESCO e pela União Internacional de Química Pura e Aplicada, IUPAC, como o Ano Internacional da Química, em homenagem ao centenário do prêmio Nobel de 1911, recebido por Marie Curie, uma das responsáveis pela descoberta dos radionuclídeos polônio e rádio, cujas reações de desintegração nucleares estão representadas, respectivamente, pelas equações I e II.
Considerando-se as informações do texto e as equações que representam a desintegração dos radionuclídeos polônio e rádio, é correto afirmar: