Questões de Vestibular Sobre química
Foram encontradas 6.467 questões
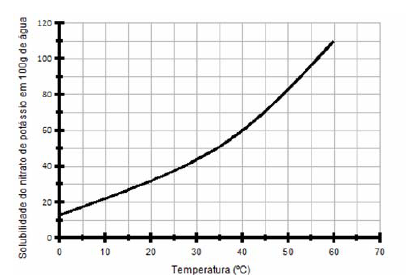
Um técnico preparou 420g de uma solução saturada de nitrato de potássio (KNO3, dissolvida em água) em um béquer a uma temperatura de 60ºC. Depois deixou a solução esfriar até uma temperatura de 40ºC, verificando a presença de um precipitado.
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)
No jornal Folha de São Paulo, de 16 de setembro de 2011, foi publicada uma reportagem sobre o Shopping Center Norte de São Paulo - SP “[...] Segundo a Cetesb, foi encontrado gás metano no terreno, que serviu como depósito de lixo na década de 1980, antes da construção do shopping [...]”.
Dado: CH4 = 16g/mol, Entalpia de combustão do metano = - 889,5 kJ/mol
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- O gás metano é uma molécula apolar, possui estrutura tetraédrica e fórmula molecular CH4.
II- O gás metano é um dos principais gases presentes no biogás.
III- A energia liberada na combustão de 100 Kg de metano é +5,56.106 kJ, aproximadamente.
IV- Caso a concentração do gás metano na região do shopping seja elevada, há o risco de ocorrer explosões.
Assinale a alternativa correta.
Quantos elétrons são produzidos a partir da oxidação de 460 μg de etanol no interior de um bafômetro informado no texto acima.?
Dado: número de Avogrado: 6.1023 CH3CH2OH = 46 g/mol
Baseado no texto e nas reações acima, juntamente com os conceitos químicos, analise as afirmações a seguir.
I- No cátodo o etanol é oxidado a etanal.
II- No ânodo ocorre uma reação de redução.
III- O sentido da corrente elétrica (i) é do ânodo para o cátodo.
IV- Na reação global corresponde a uma reação de combustão incompleta do etanol.
Assinale a alternativa correta.
O texto abaixo está presente na legislação que institui o Código de Trânsito Brasileiro- CTB.
“[...]Conduzir veículo automotor, na via pública, estando com concentração de álcool por litro de sangue igual ou superior a 6 (seis) decigramas, ou sob a influência de qualquer outra substância psicoativa que determine dependência: Penas - detenção, de seis meses a três anos, multa e suspensão ou proibição de se obter a permissão ou a habilitação para dirigir veículo automotor. [...]”
Um condutor automotivo parado em uma operação policial, após ser submetido a análises técnicas, apresentou uma concentração de 21 decigramas de álcool por litro de sangue.
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- A concentração de álcool no sangue desse condutor é de 2,1μg/μL.
II- O condutor deverá ser penalizado segundo a legislação do CTB.
III- Caso o condutor possua em seu organismo um volume de sangue igual a 5,0 L, a quantidade de álcool presente em seu corpo é de 10,5 g.
IV - A combustão completa do etanol geral CO e água.
Assinale a alternativa correta.
No jornal O Estado de São Paulo, de 16 de junho de 2011, foi publicada uma reportagem sobre uma apreensão de drogas sintéticas “[...] A Polícia Federal (PF) apreendeu cerca de 9,2 quilos de metanfetamina e 26.985 pontos de LSD, na última terça-feira, no Aeroporto Internacional de São Paulo, em Guarulhos - SP. Essa foi a primeira apreensão de drogas sintéticas este ano na rota de entrada no Brasil por esse aeroporto. [...]”.
Com base nos conceitos químicos e no texto acima, analise as afirmações a seguir.
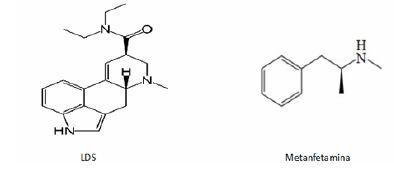
I- Tanto a metanfetamina quanto o LSD apresentam a função química amida.
II- A metanfetamina e o LSD não apresentam o fenômeno da ressonância.
III- C20H25N3O é a fórmula molecular do LSD.
IV- A metanfetamina possui fórmula molecular C10H15N.
Assinale a alternativa correta.
No jornal O Estado de São Paulo, de 30 de agosto de 2011, foi publicada uma reportagem sobre o acidente nuclear na usina Daiichi, em Fukushima no Japão “[...] em 33 localidades havia um excesso de césio-137 de 1,48 milhão de becquerel por metro quadrado, [...]”.
Com base no texto acima e nos conceitos sobre processos radioativos, analise as afirmações a seguir.
I - O césio-137 é um material radioativo com tempo de meia vida curto e não apresenta risco à saúde das pessoas que moram na região afetada pelo acidente.
II- A partícula α possui estrutura semelhante ao núcleo do átomo de hélio.
III- Processos radioativos são essencialmente transformações nucleares, na qual núcleos instáveis emitem radiações.
IV- Bequerel é uma grandeza que mede a intensidade de radiação ou a atividade radioativa.
Assinale a alternativa correta.
Como químico responsável pela destinação dos resíduos municipais, indique os processos físicos utilizados para separação do esgoto doméstico constituído por 99,9% de água e 0,1% de sólidos em suspensão, sólidos sedimentáveis e sólidos dissolvidos.
Levando em consideração o efeito da temperatura e da pressão na solubilidade dos gases em líquido, bem como as reações que ocorrem em meio ácido, pode-se afirmar o seguinte:
CO32-(aq) + 2 H+(aq) → CO2(g) + H2O(ℓ) HCO3-(aq) + H+ (aq) → CO2(g) + H2O(ℓ)
I – O aumento da temperatura e o meio ácido estomacal favorecem a eliminação do CO2. II – A uma temperatura fixa, a solubilidade dos gases diminui com a elevação da pressão. III – Os gases se tornam menos solúveis à medida que a temperatura do líquido no qual estão dissolvidos se reduz. IV – A dissolução de carbonatos e bicarbonatos reduz a acidez do líquido, devido à formação de CO2 e H2O. V – A dissolução de carbonatos e bicarbonatos não interfere no pH do produto, pois não há formação de ácidos nem bases.
(Química Nova vol.34 no.1 São Paulo 2011)

Qual dos processos abaixo NÃO envolve uma reação química?
(OLIVEIRA, Julieta Saldanha de; MARTINS, M. M. ; Appelt, Helmoz R. Trilogia: Química, Sociedade e Consumo. Química Nova na Escola, 2010. )
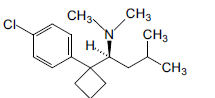
A sibutramina, um estimulante de ação central quimicamente relacionado à anfetamina, à metanfetamina e à fentermina, é indicada para redução do peso, no tratamento da obesidade. No Brasil, o cloridrato de sibutramina monoidratado pode ser encontrado nas dosagens 10 mg (equivalente a 8,37 mg de sibutramina) e 15 mg (equivalente a 12,55 mg de sibutramina). Em julho de 2010, a Diretoria Colegiada da Anvisa reduziu a quantidade de dosagem máxima diária para 15 mg de cloridrato de sibutramina monoidratado. Em relação à sibutramina, cuja estrutura está ilustrada abaixo, é INCORRETO afirmar o seguinte:
Prefeitura de São Paulo pode fechar Shopping
SÃO PAULO - O prefeito de São Paulo, Gilberto Kassab, disse nesta segunda-feira que não descarta a possibilidade de interditar o Shopping Center Norte por causa da alta concentração de gás metano no local. “A constatação [é] de que essa área, no passado, foi um lixão. Esse [antigo] lixão está emitindo gases. Caso seja confirmado, vamos ter que tomar medidas, que poderão ser [desde] a exigência por parte dos empreendedores de investimento na área para captação deste gás ou, até mesmo, medidas mais drásticas, como o fechamento temporário de parte ou todo do empreendimento”, disse o prefeito.
Fonte: http://www.valor.com.br
Qual alternativa completa corretamente as lacunas na afirmação abaixo?
O metano foi formado a partir da ___________da matéria orgânica, e a provável razão da interdição do shopping
foi que o CH4 é_______________.
Queixas chegaram à Vigilância Sanitária Estadual e foram relatadas por moradores de Canoas, São Leopoldo e Porto Alegre
Na zona sul da Capital, uma menina de 10 anos foi levada ao Hospital de Pronto Socorro (HPS) depois que sentiu uma forte ardência na boca e na garganta ao beber o produto, comprado pela avó dela, que é dona de um minimercado no bairro Guarujá. A garota foi medicada e retornou para casa nesta tarde. Segundo a responsável pelo setor de alimentos da Divisão de Vigilância Sanitária do Estado, Susete Lobo Saar de Almeida, uma análise laboratorial prévia do produto constatou alterações no pH da bebida. Esse índice, que aponta o quanto uma substância é ácida ou alcalina, estaria em torno de 13 — em uma escala que vai de zero a 14 — indicando grande alcalinidade no produto.
Fonte: http://zerohora.clicrbs.com.br
Qual das substâncias abaixo poderia ter causado o problema citado na reportagem?
Fonte: http://g1.globo.com
O esquema abaixo mostra a produção de álcool etílico a partir da cana de açúcar.
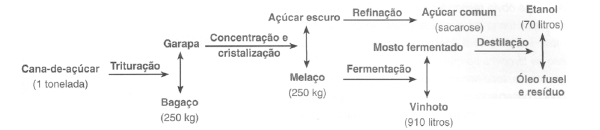
A partir dos dados informados, é possível concluir que, no período de 2011/2012, a quantidade de cana de açúcar usada para produzir o etanol será a seguinte:
I – Nos compostos (b) e (c), é possível a associação por ligações de hidrogênio intermoleculares.
II – Somente o composto (b) apresenta carbono assimétrico.
III – O composto (a) apresenta isomeria óptica.
IV – O composto (c) apresenta uma ligação iônica carbono-cloro.
