Questões de Vestibular Sobre química
Foram encontradas 6.520 questões

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.

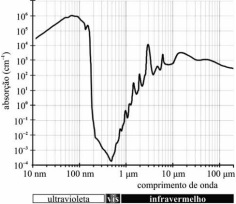
A figura I, acima, apresenta gráficos representativos da
absortividade de alguns gases da atmosfera e da atmosfera como um
todo, enquanto a figura II representa o espectro na faixa de luz
visível. Tendo como base essas figuras e considerando o número de
Avogadro igual a 6 × 1023 e a velocidade da luz igual a 3 × 108 m/s,
julgue os próximos itens.

A figura I, acima, apresenta gráficos representativos da
absortividade de alguns gases da atmosfera e da atmosfera como um
todo, enquanto a figura II representa o espectro na faixa de luz
visível. Tendo como base essas figuras e considerando o número de
Avogadro igual a 6 × 1023 e a velocidade da luz igual a 3 × 108 m/s,
julgue os próximos itens.

A figura I, acima, apresenta gráficos representativos da
absortividade de alguns gases da atmosfera e da atmosfera como um
todo, enquanto a figura II representa o espectro na faixa de luz
visível. Tendo como base essas figuras e considerando o número de
Avogadro igual a 6 × 1023 e a velocidade da luz igual a 3 × 108 m/s,
julgue os próximos itens.
A lei de Dulong-Petit, segundo a qual, a altas temperaturas, o calor específico de um sólido a volume constante deve ser igual a 3R, em que R é a constante dos gases, pode ser aplicada ao CO2.
Sabendo-se que a coloração avermelhada de Marte decorre da presença de grande quantidade de óxido de ferro na superfície do planeta, então o espectro de absorção de luz desse composto pode ser corretamente representado de acordo com a figura abaixo.
Nos estados eletrônicos fundamentais, os elétrons dos íons K+ e Cl - ocupam o mesmo número de níveis de energia.
O átomo de potássio, por ser menor que o átomo de sódio (Na), apresenta a primeira energia de ionização maior que a do átomo de Na.
O Fe2O3 pode atuar na neutralização de uma solução ácida.
As moléculas de dióxido de carbono possuem ligações covalentes polares e, por isso, as interações entre as moléculas de CO2 na neve das calotas polares de Marte são do tipo dipolo permanente-dipolo permanente.
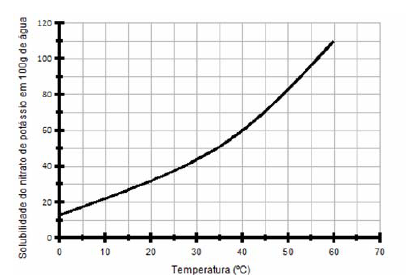
Um técnico preparou 420g de uma solução saturada de nitrato de potássio (KNO3, dissolvida em água) em um béquer a uma temperatura de 60ºC. Depois deixou a solução esfriar até uma temperatura de 40ºC, verificando a presença de um precipitado.
A massa aproximada desse precipitado é:
(desconsidere a massa de água presente no precipitado)
No jornal Folha de São Paulo, de 16 de setembro de 2011, foi publicada uma reportagem sobre o Shopping Center Norte de São Paulo - SP “[...] Segundo a Cetesb, foi encontrado gás metano no terreno, que serviu como depósito de lixo na década de 1980, antes da construção do shopping [...]”.
Dado: CH4 = 16g/mol, Entalpia de combustão do metano = - 889,5 kJ/mol
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- O gás metano é uma molécula apolar, possui estrutura tetraédrica e fórmula molecular CH4.
II- O gás metano é um dos principais gases presentes no biogás.
III- A energia liberada na combustão de 100 Kg de metano é +5,56.106 kJ, aproximadamente.
IV- Caso a concentração do gás metano na região do shopping seja elevada, há o risco de ocorrer explosões.
Assinale a alternativa correta.
Quantos elétrons são produzidos a partir da oxidação de 460 μg de etanol no interior de um bafômetro informado no texto acima.?
Dado: número de Avogrado: 6.1023 CH3CH2OH = 46 g/mol
Baseado no texto e nas reações acima, juntamente com os conceitos químicos, analise as afirmações a seguir.
I- No cátodo o etanol é oxidado a etanal.
II- No ânodo ocorre uma reação de redução.
III- O sentido da corrente elétrica (i) é do ânodo para o cátodo.
IV- Na reação global corresponde a uma reação de combustão incompleta do etanol.
Assinale a alternativa correta.
O texto abaixo está presente na legislação que institui o Código de Trânsito Brasileiro- CTB.
“[...]Conduzir veículo automotor, na via pública, estando com concentração de álcool por litro de sangue igual ou superior a 6 (seis) decigramas, ou sob a influência de qualquer outra substância psicoativa que determine dependência: Penas - detenção, de seis meses a três anos, multa e suspensão ou proibição de se obter a permissão ou a habilitação para dirigir veículo automotor. [...]”
Um condutor automotivo parado em uma operação policial, após ser submetido a análises técnicas, apresentou uma concentração de 21 decigramas de álcool por litro de sangue.
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- A concentração de álcool no sangue desse condutor é de 2,1μg/μL.
II- O condutor deverá ser penalizado segundo a legislação do CTB.
III- Caso o condutor possua em seu organismo um volume de sangue igual a 5,0 L, a quantidade de álcool presente em seu corpo é de 10,5 g.
IV - A combustão completa do etanol geral CO e água.
Assinale a alternativa correta.
No jornal O Estado de São Paulo, de 16 de junho de 2011, foi publicada uma reportagem sobre uma apreensão de drogas sintéticas “[...] A Polícia Federal (PF) apreendeu cerca de 9,2 quilos de metanfetamina e 26.985 pontos de LSD, na última terça-feira, no Aeroporto Internacional de São Paulo, em Guarulhos - SP. Essa foi a primeira apreensão de drogas sintéticas este ano na rota de entrada no Brasil por esse aeroporto. [...]”.
Com base nos conceitos químicos e no texto acima, analise as afirmações a seguir.
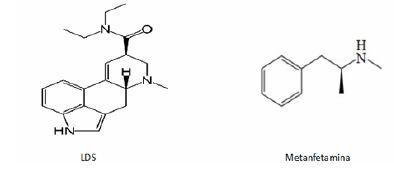
I- Tanto a metanfetamina quanto o LSD apresentam a função química amida.
II- A metanfetamina e o LSD não apresentam o fenômeno da ressonância.
III- C20H25N3O é a fórmula molecular do LSD.
IV- A metanfetamina possui fórmula molecular C10H15N.
Assinale a alternativa correta.
No jornal O Estado de São Paulo, de 30 de agosto de 2011, foi publicada uma reportagem sobre o acidente nuclear na usina Daiichi, em Fukushima no Japão “[...] em 33 localidades havia um excesso de césio-137 de 1,48 milhão de becquerel por metro quadrado, [...]”.
Com base no texto acima e nos conceitos sobre processos radioativos, analise as afirmações a seguir.
I - O césio-137 é um material radioativo com tempo de meia vida curto e não apresenta risco à saúde das pessoas que moram na região afetada pelo acidente.
II- A partícula α possui estrutura semelhante ao núcleo do átomo de hélio.
III- Processos radioativos são essencialmente transformações nucleares, na qual núcleos instáveis emitem radiações.
IV- Bequerel é uma grandeza que mede a intensidade de radiação ou a atividade radioativa.
Assinale a alternativa correta.
Como químico responsável pela destinação dos resíduos municipais, indique os processos físicos utilizados para separação do esgoto doméstico constituído por 99,9% de água e 0,1% de sólidos em suspensão, sólidos sedimentáveis e sólidos dissolvidos.
