Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Analise o gráfico que mostra a variação da eletronegatividade em função do número atômico.
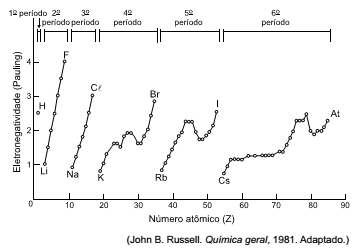
Devem unir-se entre si por ligação iônica os elementos de
números atômicos
Dos extensos efeitos nocivos que a radiação ionizante provoca na matéria viva, afigura-se a geração de radicais livres, que são espécies químicas eletricamente neutras que apresentam um ou mais elétrons desemparelhados na camada de valência. O íon cloreto, por exemplo, que, quantitativamente, constitui o principal ânion do plasma, transforma-se no radical livre Cℓ●, com 7 elétrons na camada de valência, podendo, assim, reagir facilmente com as biomoléculas, alterando o comportamento bioquímico de muitas proteínas solúveis do meio sanguíneo e também os constituintes membranários de células: hemácias, leucócitos, plaquetas.
(José Luiz Signorini e Sérgio Luís Signorini. Atividade física e radicais livres, 1993. Adaptado.)
Ao transformar-se em radical livre, o ânion cloreto
O cloreto de cobalto(II) anidro, CoCℓ2 , é um sal de cor azul, que pode ser utilizado como indicador de umidade, pois torna-se rosa em presença de água. Obtém-se esse sal pelo aquecimento do cloreto de cobalto(II) hexa-hidratado, CoCℓ2 .6H2O, de cor rosa, com liberação de vapor de água.
sal hexa-hidratado (rosa) 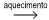 sal anidro (azul) + vapor de água
sal anidro (azul) + vapor de água
A massa de sal anidro obtida pela desidratação completa de 0,1 mol de sal hidratado é, aproximadamente,
O quadro fornece indicações sobre a solubilidade de alguns compostos iônicos inorgânicos em água a 20 ºC.
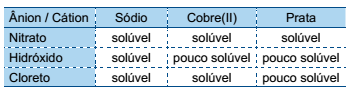
Em um laboratório, uma solução aquosa obtida a partir da
reação de uma liga metálica com ácido nítrico contém nitrato
de cobre(II) e nitrato de prata. Dessa solução, pretende-se
remover, por precipitação, íons de prata e íons de cobre(II),
separadamente. Para tanto, pode-se adicionar à mistura uma
solução aquosa de
Na formulação da calda bordalesa fornecida pela EMATER, recomenda-se um teste para verificar se a calda ficou ácida: coloca-se uma faca de aço carbono na solução por três minutos. Se a lâmina da faca adquirir uma coloração marrom ao ser retirada da calda, deve-se adicionar mais cal à mistura. Se não ficar marrom, a calda está pronta para o uso. De acordo com esse teste, conclui-se que a cal deve promover
Dados de massas molares em g∙mol-1: sulfato de cobre (II) pentaidratado = 250; hidróxido de cálcio = 74.
Dados de massas atômicas em Dalton: C = 12 e H = 1.
No Brasil, cerca de 12 milhões de pessoas sofrem de diabetes mellitus, uma doença causada pela incapacidade do corpo em produzir insulina ou em utilizá-la adequadamente. No teste eletrônico para determinar a concentração da glicose sanguínea, a glicose é transformada em ácido glucônico e o hexacianoferrato(III) é transformado em hexacianoferrato(II), conforme mostra o esquema a seguir.
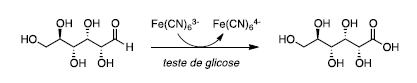
Em relação ao teste eletrônico, é correto afirmar que
Em 12 de maio de 2017 o Metrô de São Paulo trocou 240 metros de trilhos de uma de suas linhas, numa operação feita de madrugada, em apenas três horas. Na solda entre o trilho novo e o usado empregou-se uma reação química denominada térmita, que permite a obtenção de uma temperatura local de cerca de 2.000 °C. A reação utilizada foi entre um óxido de ferro e o alumínio metálico. De acordo com essas informações, uma possível equação termoquímica do processo utilizado seria
O livro O Pequeno Príncipe, de Antoine de Saint-Exupéry, uma das obras literárias mais traduzidas no mundo, traz ilustrações inspiradas na experiência do autor como aviador no norte da África. Uma delas, a figura (a), parece representar um chapéu ou um elefante engolido por uma jiboia, dependendo de quem a interpreta.
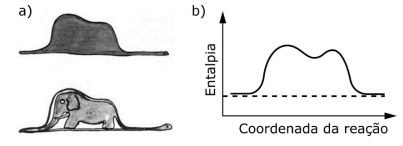
Para um químico, no entanto, essa figura pode se
assemelhar a um diagrama de entalpia, em função da
coordenada da reação (figura b). Se a comparação for
válida, a variação de entalpia dessa reação seria
Com a crise hídrica de 2015 no Brasil, foi necessário ligar as usinas termoelétricas para a geração de eletricidade, medida que fez elevar o custo da energia para os brasileiros. O governo passou então a adotar bandeiras de cores diferentes na conta de luz para alertar a população. A bandeira vermelha indicaria que a energia estaria mais cara. O esquema a seguir representa um determinado tipo de usina termoelétrica.
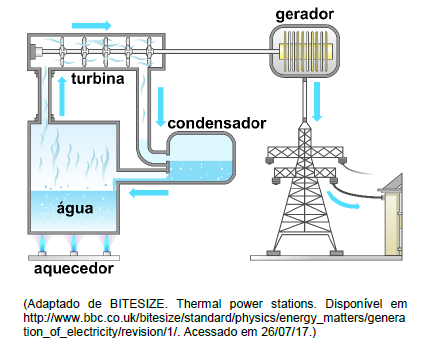
Conforme o esquema apresentado, no funcionamento da
usina há
A galvanoplastia consiste em revestir um metal por outro a fim de protegê-lo contra a corrosão ou melhorar sua aparência. O estanho, por exemplo, é utilizado como revestimento do aço empregado em embalagens de alimentos. Na galvanoplastia, a espessura da camada pode ser controlada com a corrente elétrica e o tempo empregados. A figura abaixo é uma representação esquemática desse processo.
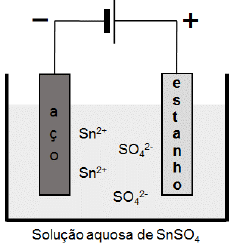
Considerando a aplicação de uma corrente constante com
intensidade igual a 9,65 x 10-³ A, a massa depositada de
estanho após 1 min 40 s será de aproximadamente
Dados: 1 mol de elétrons corresponde a uma carga de 96.500
C; Sn: 119 g∙mol-¹.
Examine as estruturas do ortocresol e do álcool benzílico.
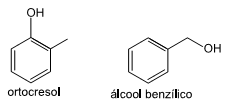
O ortocresol e o álcool benzílico
O ciclo do enxofre é fundamental para os solos dos manguezais. Na fase anaeróbica, bactérias reduzem o sulfato para produzir o gás sulfeto de hidrogênio. Os processos que ocorrem são os seguintes:
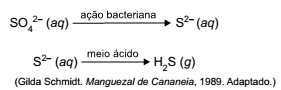
Na produção de sulfeto de hidrogênio por esses processos
nos manguezais, o número de oxidação do elemento
enxofre
Analise os três diagramas de entalpia.
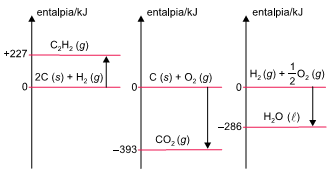
O ∆H da combustão completa de 1 mol de acetileno, C2H2 (g), produzindo CO2 (g) e H2O (ℓ) é
Sob temperatura constante, acrescentou-se cloreto de sódio em água até sobrar sal sem se dissolver, como corpo de fundo. Estabeleceu-se assim o seguinte equilíbrio:
NaCℓ (s) ⇌ Na+ (aq) + Cℓ – (aq)
Mantendo a temperatura constante, foi acrescentada mais uma porção de NaCℓ (s). Com isso, observa-se que a condutibilidade elétrica da solução sobrenadante ________ , a quantidade de corpo de fundo _______________ e a concentração de íons em solução ________ .
As lacunas do texto devem ser preenchidas, respectivamente, por:
Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram determinadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
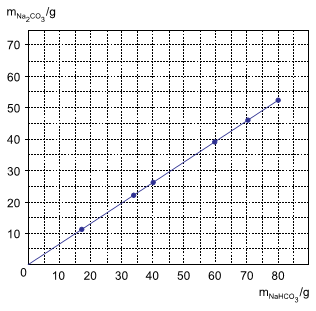
Os dados do gráfico permitem concluir que as massas de
carbonato de sódio e bicarbonato de sódio nessa reação
estão relacionadas pela equação 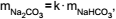 e
que o valor aproximado de k é
e
que o valor aproximado de k é