Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Basicamente, o vidro é obtido a partir de uma reação de fusão a 1500 °C entre o carbonato de sódio (Na2CO3), conhecido como barrilha, o calcário (CaCO3) e a sílica presente na areia (SiO2):
Na2CO3 + CaCO3 + SiO2 → silicatos de sódio e cálcio (vidro comum) + gás carbônico.

(Fonte: http://alunosonline.uol.com.br/quimica/curiosidades-sobre-vidro.html Acesso em jan. 2018.)
Ele é um tipo de material dos mais utilizados nas tarefas do dia a dia, não é biodegradável e pode ser reciclado várias vezes sem, no entanto, perder suas características e propriedades.
Com base nas informações do texto e com o propósito de atenuar os danos ambientais causados pelo descarte de materiais
de vidro, tem-se que
Os filmes de super-heróis dos quadrinhos se tornaram um fenômeno do cinema nos últimos anos. Um exemplo é o Homem de Ferro, personagem fictício dos quadrinhos publicados pela Marvel Comics. Sua identidade verdadeira é a do empresário e bilionário Tony Stark, que usa armaduras de alta tecnologia no combate ao crime.
Seu traje é feito de titânio (22Ti48), reforçado com fibra de carbono e revestimento cerâmico (usado em coletes à prova de balas e blindagem de carros). Já o capacete é hermeticamente selado, não permitindo, por isso, contaminação por fumaça ou venenos. A viseira é retrátil e um processador ligado à cabeça capta os sinais do cérebro, interpreta as ordens e as repassa para o traje. Instalado no peito do herói, um reator realiza a fusão fria do elemento paládio (46Pd106) para gerar a energia que alimenta as partes-chaves do traje. Além disso, ele também é capaz de disparar raios de energia.

(Fonte: https://www.pinterest.pt/jucianim/desenho/?lp=true Acesso em jan. 2018.)
Em relação aos elementos químicos constituintes do traje do
Homem de Ferro,
O fermento químico é um ingrediente muito utilizado na cozinha para fazer crescer as massas, sendo a principal a de farinha de trigo. O crescimento ocorre devido à formação de gás carbônico dentro da massa, quando o fermento é adicionado a ela. Graças a ele, podemos provar alimentos macios e de digestão fácil. Observe a reação entre as substâncias que compõem um determinado fermento químico, quando o mesmo é adicionado à massa de um alimento que está sendo produzido:
8NaHCO3 + 3Ca(H2PO4)2 → Ca3(PO4)2 + 4Na2HPO4 + 8CO2 + 8H2O
Considerando a reação dada, qual é a massa, em gramas, de CO2 produzido quando 60 gramas de NaHCO3 reagem totalmente com Ca(H2PO4)2?
Dados: NaHCO3: 84 g/mol; CO2: 44 g/mol
As figuras representam dois modelos, 1 e 2, para o átomo de hidrogênio. No modelo 1, o elétron move-se em trajetória espiral, aproximando-se do núcleo atômico e emitindo energia continuamente, com frequência cada vez maior, uma vez que cargas elétricas aceleradas irradiam energia. Esse processo só termina quando o elétron se choca com o núcleo. No modelo 2, o elétron move-se inicialmente em determinada órbita circular estável e em movimento uniforme em relação ao núcleo, sem emitir radiação eletromagnética, apesar de apresentar aceleração centrípeta. Nesse modelo a emissão só ocorre, de forma descontínua, quando o elétron sofre transição de uma órbita mais distante do núcleo para outra mais próxima.
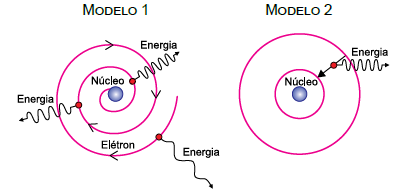
A respeito desses modelos atômicos, pode-se afirmar que
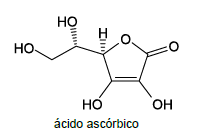
Um comprimido efervescente contendo 1 g de vitamina C foi dissolvido em água, de modo a obter-se 200 mL de solução. A concentração de ácido ascórbico na solução obtida é, aproximadamente,
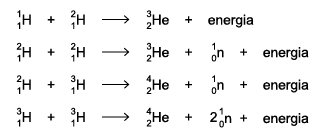
Estima-se que, a cada segundo, 657 milhões de toneladas de hidrogênio estejam produzindo 653 milhões de toneladas de hélio. Supõe-se que a diferença, 4 milhões de toneladas, equivalha à energia liberada e enviada para o espaço.
(Angélica Ambrogi et al. Unidades modulares de química, 1987. Adaptado.)
Sobre a situação apresentada no texto foram feitas três afirmações:
I. A quantidade de energia enviada para o espaço a cada segundo, equivalente a aproximadamente 4 milhões de toneladas de hidrogênio, pode ser estimada pela equação de Einstein, E = mc2 .
II. Todas as reações de fusão nuclear representadas são endotérmicas.
III. No conjunto das equações apresentadas, nota-se a presença de 3 isótopos do hidrogênio e 2 do hélio.
É correto o que se afirma somente em
Leia o texto para responder a questão.

Voando na altitude de cruzeiro com uma velocidade média, em relação ao solo, de 800 km/h, um Boeing 737-800 percorreu uma distância de 2400 km.
Considere que:
• o QAV é constituído por hidrocarbonetos cujas cadeias
carbônicas contêm, em média, 12 átomos de carbono
e 26 átomos de hidrogênio, apresentando massa molar
média de 170 g/mol;
• a combustão do QAV na altitude de cruzeiro é completa.
De acordo com os dados, a massa de CO2
(g) gerada pela
combustão do QAV na distância percorrida pelo avião foi próxima de

Os nitritos são considerados mutagênicos. Sua hidrólise produz ácido nitroso (HNO2 ), que reage com bases nitrogenadas do DNA. A reação desse ácido com a adenina (A) produz hipoxantina (H), cuja estrutura molecular está representada a seguir.
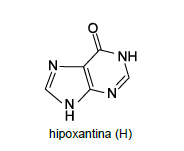
Como a hipoxantina (H) apresenta estrutura molecular semelhante à da __________ , ocorre um erro de pareamento entre bases, que passa a ser _________ em vez de A-T.
As lacunas do texto são preenchidas por


Consideram-se arte rupestre as representações feitas sobre rochas pelo homem da pré-história, em que se incluem gravuras e pinturas. Acredita-se que essas pinturas, em que os materiais mais usados são sangue, saliva, argila e excrementos de morcegos (cujo hábitat natural são as cavernas), têm cunho ritualístico.
(www.portaldarte.com.br. Adaptado.)
Todos os materiais utilizados para as pinturas, citados no
texto, são
Um laboratório de controle ambiental recebeu para análise uma amostra de gás sem identificação. Após algumas medidas, foram obtidos os seguintes dados:
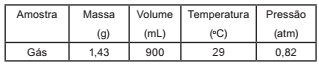
Com base nos valores obtidos, entre os gases indicados
nas opções, conclui-se que a amostra era de:
As pilhas são dispositivos que receberam esse nome porque a primeira pilha inventada por Alessandro Volta, no ano de 1800, e era formada por discos de zinco e cobre separados por um algodão embebido em salmoura. Tal conjunto era colocado de forma intercalada, um em cima do outro, empilhando os discos e formando uma grande coluna. Como era uma pilha de discos, começou a ser chamada por esse nome.
Afirma-se que, numa pilha eletroquímica, sempre ocorre
I oxidação no ânodo.
II movimentação de elétrons no interior da solução eletrolítica.
III passagem de elétrons, no circuito externo, do cátodo para o ânodo.
IV uma reação de oxirredução.
São verdadeiras apenas as afirmações estabelecidas em:
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
A desomorfina, assim como a morfina e a heroína, é um derivado do ópio. Usada para fins medicinais na terapia da dor crônica e aguda de alta intensidade, a desomorfina produz fortes ações de insensibilidade à dor. A ingestão de doses elevadas da substância causa euforia, estados hipnóticos e dependência. A desomorfina é de 8 a 10 vezes mais potente que a morfina, tratando-se de um opiáceo sintético com estrutura quase idêntica à da heroína, mas muito mais barata.
Supondo que, a 25 °C, a desomorfina tenha um pKa de 9,69, a morfina tenha um pKa de 8,21 e a heroína tenha um pKa de 7,60, tem-se que a
Muitos dos protetores solares disponíveis no mercado contêm duas substâncias químicas: a oxibenzona e o octinoxato. Estudos científicos realizados em laboratório associam essas substâncias a problemas de reprodução e de branqueamento de corais, o que os deixa enfraquecidos e, com o tempo, os leva à morte. Em 2016, uma equipe de cientistas americanos relatou que essas substâncias poderiam interromper o crescimento dos corais. Esses filtros químicos são liberados pela pele humana à medida que as pessoas mergulham, nadam ou surfam no mar.
Considere as fórmulas estruturais planas:
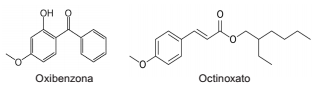
Em relação a essas moléculas, é correto afirmar que
O dióxido de titânio, além de ser empregado como aditivo alimentar, é comumente usado para pigmentação branca em tintas, papel e plásticos. É também um ingrediente ativo, em protetores solares baseados em minerais, usado para a pigmentação com o objetivo de bloquear a luz ultravioleta. Além disso, o óxido também é usado em alguns chocolates para dar uma textura suave; em donuts, para fornecer cor; e em leites desnatados, para dar uma aparência mais brilhante, mais opaca, o que torna o produto mais saboroso.
Uma das reações utilizadas para a sua produção é a cloração de um mineral de titânio (ilmenita) cuja equação é a seguinte:
x FeTiO3 (s) + y Cl2 (g) + z C(s) → a FeCl2 (s) + bTiO2(s) + c CO2 (g)
Os números para os coeficientes x, y, z, a, b, c, que tornam
essa equação balanceada, são, respectivamente: