Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Numa sessão de estudos, alunos do Ensino Médio necessitavam responder a questão que tinha a seguinte informação: S(g) + 3/2 O2(g) → SO3(g) ΔH = -94,4Kcal/mol que é a equação termoquímica de um problema.
Pode-se afirmar que quando 120g de SO3(g) são formados: (Dado: S = 32g, O = 16g)
Com relação às equações abaixo:
CaO(s) + CO2(g) → CaCO3(s)
2NaI(aq)+ Br(aq) → 2 NaBr(aq) + I2(aq)
com certeza são exemplos de reações de:
Os compostos iônicos e moleculares interferem de formas diferentes na variação da pressão osmótica de um organismo. Como regra geral, podemos afirmar que, considerando uma mesma quantidade de matéria, os efeitos causados pelo consumo de sal são mais intensos que os de açúcar. Considere que soluções aquosas diferentes tenham sido preparadas com 50 g de nitrato de cálcio e 50 g de glicerina (propan-1,2,3-triol), formando dois sistemas em que cada um apresente 2,0 litros de solução a 20 ºC. A razão existente entre a pressão osmótica do sistema salino em relação à pressão osmótica do sistema alcólico é, aproximadamente:
Use 0,082 atm.L/mol.K para a constante universal dos gases perfeitos.
Mais do que classificar os compostos e agrupá-los como funções em virtude de suas semelhanças químicas, a Química Orgânica consegue estabelecer a existência de inúmeros compostos. Um exemplo dessa magnitude é a isomeria, que indica que compostos diferentes podem apresentar a mesma fórmula molecular. A substância a seguir apresenta vários tipos de isomeria, algumas delas perceptíveis em sua fórmula estrutural e outras a partir do rearranjo de seus átomos, que poderiam formar outros isômeros planos.
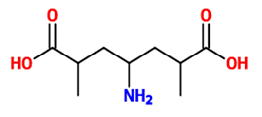
A partir da estrutura apresentada, as funções orgânicas que podem ser observadas e o número de isômeros opticamente
ativos para o referido composto são, respectivamente:
O Princípio de Le Chatelier infere que quando uma perturbação é imposta a um sistema químico em equilíbrio, este irá se deslocar de forma a minimizar tal perturbação.
Disponível em: <brasilescola.com/exercicios-quimica/exercicios-sobre-principio-le-chatelier.htm>
O gráfico apresentado a seguir indica situações referentes à perturbação do equilíbrio químico indicado pela equação
H2(g) + I2(g) 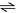 2 HI(g)
2 HI(g)
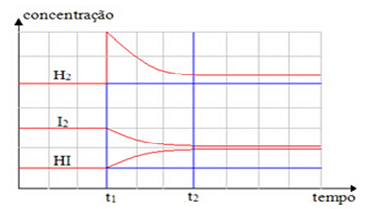
A partir da equação química apresentada e da observação do gráfico, considerando também que a reação é endotérmica
em favor da formação do ácido iodídrico, a dinâmica do equilíbrio favorecerá
O airbag é um equipamento de segurança na forma de bolsas infláveis que protege os ocupantes de veículos em caso de acidente e tem como princípio fundamental reações químicas. Esse dispositivo é constituído de pastilhas contendo azida de sódio e nitrato de potássio, que são acionadas quando a unidade de controle eletrônico envia um sinal elétrico para o ignitor do gerador de gás. A reação de decomposição da azida de sódio (NaN3) ocorre a 300 °C e é instantânea, mais rápida que um piscar de olhos, cerca de 20 milésimos de segundo, e desencadeia a formação de sódio metálico e nitrogênio molecular, que rapidamente inflam o balão do airbag. O nitrogênio formado na reação é um gás inerte, não traz nenhum dano à saúde, mas o sódio metálico é indesejável. Como é muito reativo, acaba se combinando com o nitrato de potássio, formando mais nitrogênio gasoso e óxidos de sódio e potássio, segundo as reações a seguir:
NaN3 → Na + N2
Na + KNO3 → K2O + Na2O + N2
Considerando uma pastilha de 150 g de azida de sódio com 90% de pureza, o volume aproximado de gás nitrogênio produzido nas condições ambientes é de:
Dados: Volume molar de gás nas condições ambientes = 25 L/mol e massa molar do NaN3 = 65 g/mol.
Analise a questão abaixo.
Reações no estado gasoso com Δn>0 apresentam ΔS>0.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A reação I é mais espontânea que a reação II.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A adição de um catalisador na reação II, em equilíbrio, favorece o rendimento em H2
.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Uma diminuição de pressão favorece a formação de CO2
na reação I.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A constante de equilíbrio para a reação II, a 298K, é 1,05.10–5.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Como as ordens de reação estão sempre de acordo com sua estequiometria, a lei cinética da reação II
é v= k[CO].[H2O].