Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
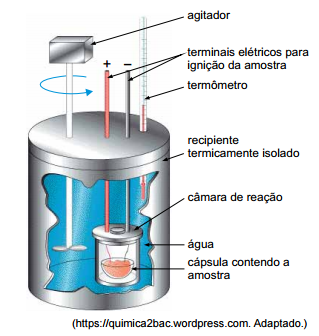
A tabela nutricional de determinado tipo de azeite de oliva traz a seguinte informação: “Uma porção de 13 mL (1 colher de sopa) equivale a 108 kcal.” Considere que o calor específico da água seja 1 kcal · kg–1 · ºC–1 e que todo o calor liberado na combustão do azeite seja transferido para a água. Ao serem queimados 2,6 mL desse azeite, em um calorímetro contendo 500 g de água inicialmente a 20,0 ºC e à pressão constante, a temperatura da água lida no termômetro deverá atingir a marca de
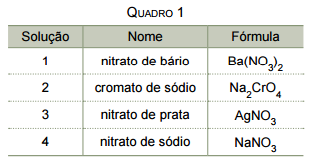
O quadro 2 apresenta o resultado das misturas, de volumes iguais, de cada duas dessas soluções.
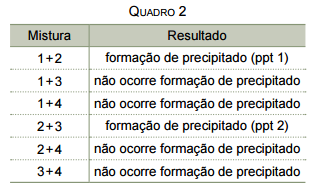
De acordo com essas informações, os precipitados formados, ppt 1 e ppt 2, são, respectivamente,
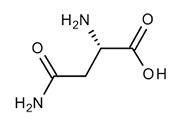
Os alimentos ricos em asparagina são, principalmente, alimentos ricos em proteína. A asparagina é um aminoácido não essencial porque independe da ingestão de alimentos ricos em nutrientes, pois o organismo consegue produzi-lo quando necessário. Uma das funções da asparagina é manter as células do sistema nervoso saudáveis e contribuir para a formação e manutenção de ossos, pele, unhas e cabelos, por exemplo. A asparagina serve para formar dentro do organismo novas proteínas de acordo com a necessidade do organismo em cada momento.
Disponível em: <http://www.tuasaude> .
Analisando o texto e a fórmula da asparagina apresentada a seguir, assinale a alternativa CORRETA.
Dado: Número atômico: H = 1, C = 6, N = 7, O = 8
“O ácido Sulfúrico é tido como um indicador da economia de um país, pois é o produto químico mais utilizado
pela indústria. Sua aplicação tem larga escala, desde em fertilizantes e baterias de automóveis, até
no refino do petróleo. É extremamente solúvel em água, porém, isto deve ser feito com muita cautela,
pois seus vapores são liberados agressivamente”.
Disponível em: <http://www.brasilescola.com/> .
Uma das maneiras de produzi-lo é através das reações com oxigênio, o qual ocupa uma fração de 21%, aproximadamente, no ar atmosférico. A partir das informações fornecidas e utilizando as reações não balanceadas apresentadas a seguir, referentes às etapas de produção de ácido sulfúrico, assinale a alternativa CORRETA.
Dados: (Ma (g/mol): H = 1, O = 16, S= 32). Volume molar na CNTP: 22,71 L/mol, Avogadro = 6X1023
I) S8(s) + O2(g) → SO2(g)
II) SO2(g)+ O2(g) → SO3(g)
III) SO3(g) + H2O (l) → H2SO4 (aq)
Os efeitos tóxicos do dióxido de carbono exigem a sua remoção contínua de espaços fechados. A reação entre hidróxido de lítio e de dióxido de carbono é usada para remover o gás de naves espaciais e submarinos. O filtro utilizado nestes equipamentos é basicamente composto de hidróxido lítio. O ar seria direcionado para o filtro através de ventiladores, ao entrar em contato com o hidróxido de lítio presente nos filtros ocorre a reação com o dióxido de carbono existente no ar. A reação global é exotérmica, formando carbonato de lítio sólido e água no estado gasoso.
Disponível em: <http://www.abq.org.br/cbq/2014/trabalhos/14/4463-18723.html>.
Analisando o texto e a reação não balanceada, assinale a alternativa CORRETA.
CO2(g) + LiOH(s) → Li2CO3(s) + H2O(v)
O ácido permangânico é um composto instável, de cor branca, extremamente corrosivo, o qual oxida em soluções aquosas. Já o hidróxido de ferro III é uma base insolúvel em água que, em conjunto com outras substâncias, pode servir, por exemplo, em medicina para ajudar a tratar anemias.
Disponível em: <http://www.quimica.seed.pr.gov.br> .
No que diz respeito aos ácidos e bases, assinale a alternativa CORRETA.
Dadas massas atômicas em (g/mol): H = 1, O = 16, Mn = 55, Fe = 56
O sulfato de potássio e o permanganato de potássio são duas importantes substâncias. O sulfato de potássio é utilizado na agricultura como um dos constituintes dos fertilizantes, pois ajuda na adubação das culturas que estão com carência de potássio, ao passo que o permanganato de potássio é utilizado no tratamento da catapora, pois ajuda a secar os ferimentos causados pela doença. A reação a seguir mostra uma maneira de produzir o sulfato de potássio a partir do permanganato de potássio. Considerando as informações apresentadas e a análise da reação não balanceada, assinale a alternativa CORRETA.
Dados: massas atômicas em (g/mol): H= 1, O= 16, S = 32, K = 39, Mn = 55
KMnO4(aq) + H2SO4(aq) + H2O2(aq) → K2SO4(aq) + H2O(l) + MnSO4(aq) + O2(g)
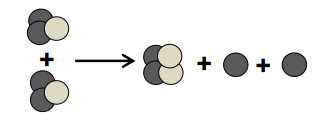
De acordo com esse esquema, pode-se concluir que essa transformação, que liberaria muita energia, é uma
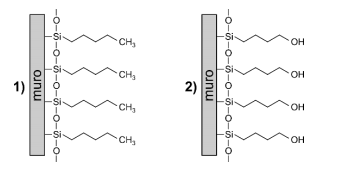
Como a urina é constituída majoritariamente por água, e levando-se em conta as forças intermoleculares, pode-se afirmar corretamente que

