Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Em condições reacionais adequadas, hidrogênio, H2(g) e cloro, Cℓ 2(g) reagem entre si formando cloreto de hidrogênio, HCℓ (g). Esse processo é reversível e exotérmico, podendo ser representado por
H2(g) + Cℓ 2(g) 2 HCℓ (g) ΔH = - 92,3 kJ . mol –1 .
Depois de atingido o equilíbrio, o fator que não altera esse estado de equilíbrio é a variação da
As vitaminas solúveis em água têm estrutura com alta proporção de átomos eletronegativos, como o oxigênio e o nitrogênio, que promovem forte interação com a água. A seguir estão representadas quatro vitaminas:
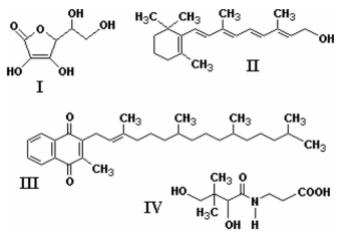
Dentre elas, é mais adequado adicionar-se a sucos de frutas a vitamina
A sílica, ou óxido de silício, SiO2, é um sólido covalente empregado na fabricação do vidro e do cimento Portland.
As ligações químicas presentes na sílica envolvem
O teste de chama é uma técnica utilizada para identificar átomos ou cátions presentes em substâncias ou misturas. Por exemplo, quando uma pequena quantidade de cloreto de sódio é levada à chama de um bico de Bunsen, observa-se que a chama inicialmente azul adquire uma coloração laranja. Assim, na queima de fogos de artifício, verificamos várias cores devido aos diferentes sais utilizados na fabricação dos fogos.
Essas cores podem ser explicadas pelo modelo atômico de
O estado de equilíbrio existente em um frasco contendo solução de amoníaco, mantido fechado e a temperatura constante, pode ser representado pelas equações:
I - NH3(g) ⇌ NH3 (aq)
II - NH3 (aq) + H2O ⇌ NH4+(aq) + OH-(aq)
III - 2H2O ⇌ H3O+ + OH-
Se o frasco for aberto e assim permanecer por algumas horas, a concentração de
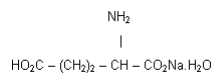
A análise dessa fórmula leva a concluir que esse aditivo
Considere as seguintes espécies:
I. Fe
II. Fe3+
III. Fe2+
É correto afirmar:
A sacarose, C12H22O11 , é uma substância molecular. Em relação à sacarose são feitas as seguintes afirmativas:
I. É uma substância polar.
II. É muito solúvel em água.
III. Suas soluções aquosas não apresentam condutividade elétrica apreciável.
Das afirmações anteriores estão corretas:
Considere o enunciado para o modelo atômico:
“O átomo é uma minúscula esfera maciça, impenetrável, indestrutível, indivisível e sem carga.”
Tal enunciado refere-se ao modelo atômico proposto por:
Um estudante de Engenharia Química pipeta 50mL de solução aquosa 0,02mol/L de ácido clorídrico e transfere para um balão volumétrico de 1000mL, ajustando-se para esse volume a solução final, usando água pura.
O pH da solução final é igual a
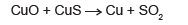
Com base nos conhecimentos sobre cálculos estequiométricos, a massa de cobre obtida quando 159 kg de óxido de cobre reagem completamente com sulfeto de cobre é, aproximadamente,
O gás nitrogênio (N2) reage com o gás oxigênio (O2), conforme a reação a seguir:
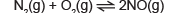
Considere que a constante de equilíbrio da reação é igual a 16 e que as concentrações de equilíbrio de N2 e O2 são, respectivamente, 02mol/L e 02mol/L.
Baseado nos conhecimentos sobre sistemas reversíveis, o valor da concentração molar de NO é igual a
Sobre catalisadores, são feitas as quatro afirmações seguintes.
I. São substâncias que aumentam a velocidade de uma reação.
II. Reduzem a energia de ativação da reação.
III. As reações nas quais atuam não ocorreriam nas suas ausências.
IV. Enzimas são catalisadores biológicos.
Com base nos conhecimentos sobre cinética química, dentre as afirmações apresentadas estão corretas: