Questões de Vestibular Sobre química
Foram encontradas 6.520 questões
Assim como o diamante e os fulerenos, o grafeno é um alótropo do Carbono (Z = 6) tendo a espessura de apenas um átomo. Por apresentar alta resistência, leveza e ser excelente semicondutor, tem sido um dos materiais mais promissores empregados em nanotecnologia e inovação.
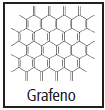
Sobre o grafeno e o átomo de carbono, analise os itens a seguir:
I) Todos os átomos de carbono do grafeno possuem hibridização sp2 e geometria trigonal plana, com orbitais “p” perpendiculares ao plano formado pelos anéis aromáticos.
II) A distribução eletrônica dos átomos de carbono no grafeno é 1s2 , 2s2 , 2p2 .
III) O átomo de carbono pode apresentar três tipos de hibridização diferentes ao formar ligações covalentes.
IV) Os átomos de carbono tetraédricos podem fazer quatro ligações iguais, usando orbitais não hibridizados.
Estão corretos apenas:
O triptofano é um aminoácido essencial que desempenha diversas funções no organismo humano, sendo usado na biossíntese de proteínas e como precursor bioquímico na síntese da serotonina.
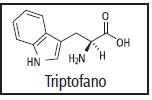
Sobre sua estrutura química, analise os seguintes itens:
I) É um composto que contém apenas um átomo de carbono quiral, com configuração absoluta (S).
II) É uma amina alifática secundária que atua como base de Lewis e pode ser protonada em pH muito ácido.
III) É um aminoácido que possue em sua estrutura um cicloalcano não aromático com duplas ligações alternadas.
IV) O grupo carboxila é responsável pela acidez da molécula e pode ser desprotonado em meio básico.
Estão corretos apenas:
“As armas químicas são vistas como cruéis e incomuns. Mesmo sendo consideradas menos eficazes do que os armamentos mais tradicionais, as armas químicas representam uma grande ameaça”.
(Adaptado de https://www.fatosdesconhecidos. com.br/7-terriveisarmas-quimicas-que-existem/, acessado em 05/08/2019)
As estruturas de alguns compostos utilizados em situação de Guerra são apresentados abaixo:
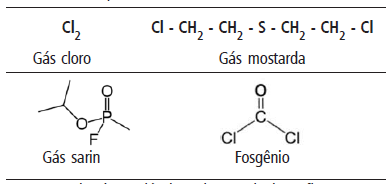
A respeito das moléculas acima, assinale a afirmação correta.
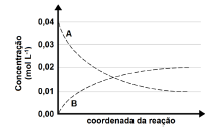
Com base nas informações, analise os itens I a III.
I) A reação balanceada entre as espécies citadas é 3A⇔2B. II) O valor da constante de equilíbrio da reação é 4x102 . III) O equilíbrio estabelecido é deslocado para os produtos ao se diminuir o volume do recipiente.
Está(ão) correto(s):
Em A e B são representadas duas reações características de compostos aromáticos.
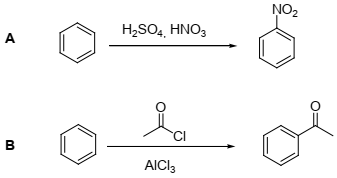
Assinale a alternativa que nomeia, respectivamente, as reações A e B:
Três compostos, assinalados como A, B e C, são apresentados abaixo:
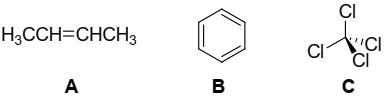
Com base nas estruturas moleculares desses compostos, é correto concluir que
Um dos tipos de pilha mais eficientes são as de lítio. A reação redox que ocorre nessas pilhas é, simplificadamente, representada a seguir:
2 Li (s) + I2 (s) → 2 Li+ (aq) + 2 I−(aq)
Dados:
Eo Li+/Li = −3,05 V
Eo I2 /I− = +0,53 V
As nanopartículas de prata, usadas em diversas aplicações tecnológicas, podem ser preparadas, em solução aquosa, pela redução de íons Ag+ usando boro-hidreto de sódio (NaBH4), como indicado na equação abaixo:
AgNO3 (aq) + NaBH4 (aq) → Ag (s) + ½ H2 (g) + ½ B2H6 (g) + NaNO3 (aq)
A partir de 100,00 mL de uma solução 2,0 × 10-3 mol L-1 de AgNO3, qual seria a massa mínima de NaBH4 necessária para a reação completa de Ag+ para Ag, expressa em gramas?
Dados:
M(AgNO3) = 170 g mol-1
M(Ag) = 108 g mol-1
M(NaBH4) = 38 g mol-1
O ácido sulfídrico, H2S, pode ser eletroquimicamente reagido, produzindo enxofre elementar, segundo a reação abaixo:
H2S(aq) + I2(aq) → S(s) + 2H+(aq) + 2I−aq)
Na tabela abaixo, a coluna da esquerda lista cinco compostos inorgânicos, e a coluna da direita, aplicações típicas para estes.
Composto inorgânico
1 – HNO3
2 – NH3
3 – H2CO3
4 – Mg(OH)2
5 – HF
Possibilidade de aplicação
( ) Produção de explosivos
( ) Produção de antiácidos estomacais
( ) Produção de bebidas gaseificadas
( ) Produção de fertilizantes
Uma solução de soro fisiológico tem 0,9% (m/v) de cloreto de sódio na sua composição. A concentração em quantidade de matéria (mol L-1 ) do íon sódio no soro fisiológico é
Dado
MNaCℓ = 58,5 g mol-1
 CH3
CH2
OH CH2Cℓ COOH CH3
COOH
CH3
CH2
OH CH2Cℓ COOH CH3
COOH
Fenol Etanol Ácido cloroacético Ácido acético
(1) (2) (3) (4)
Levando em conta a numeração adotada, assinale a alternativa onde o fenol (1), o etanol (2), o ácido cloroacético (3) e o
ácido acético (4) estão dispostos em ordem crescente de acidez.
Um comprimido efervescente de vitamina C contém 500 mg de ácido ascórbico (C6H8O6 ). Quando um paciente bebe água em que foram dissolvidos dois comprimidos de vitamina C, ele consumiu um número mais próximo de moléculas de ácido ascórbico de
Dados
MC6H8O6= 176 g mol-1
N° Avogadro = 6 x 1023 moléculas . mol-1
Os gases hidrogênio e bromo foram colocados para reagir, até o equilíbrio ser atingido, segundo a equação abaixo.
H2(g) + Br2(g) ⇌ 2 HBr(g) ; ΔH° < 0
A tabela a seguir tem duas colunas, uma que indica um tipo de perturbação do equilíbrio e outra que indica a situação final do equilíbrio restabelecido.
Perturbação do equilíbrio
I – aumento da temperatura
II – aumento da pressão pela diminuição do volume do reator
III – adição de catalisador
IV – adição de Br2(g)
Situação final do equilíbrio restabelecido
P – aumento da concentração
de HBr(g)
Q – aumento da concentração de Br2(g)
R – sem alteração signifi cativa das concentrações de equilíbrio
A associação CORRETA de perturbação e situação final do equilíbrio restabelecido é indicada na alternativa
O ácido tereftálico é um diácido carboxílico com fórmula molecular C8H6O4 , muito utilizado na produção de poliéster do tipo PET (polietilenotereftalato).
O percentual mais aproximado em massa de carbono, hidrogênio e oxigênio no ácido tereftálico é:
Dados
MC = 12 g mol-1
MH = 1 g mol-1
MO = 16 g mol-1
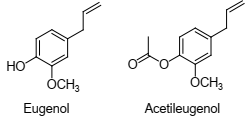
Sobre esses compostos, assinale a única afirmativa correta.
Uma solução salina foi preparada pela dissolução completa de 0,220 g de CaCl2 em água pura, sendo o volume final da solução ajustado para 250,00 mL num balão volumétrico. A concentração, em mol L-1, do íon cloreto (Cl- ) na solução é mais próxima de
Dado:
M(CaCl2) = 111 g mol-1