Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
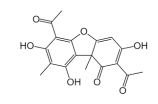
Sobre o ácido úsnico é INCORRETO afirmar que:
As reações envolvidas no processo são:
C8O2H7CO2H (aq) + NaOH (aq) → C8O2H7CO2Na (aq) + H2O (l) H2SO4 (aq) + 2 NaOH (aq) → Na2SO4 (aq) + 2 H2O (l)
Dada a massa molar do ácido acetilsalicílico = 180 g/mol.
O teor (percentual em massa) de ácido acetilsalicílico encontrado pelo estudante no comprimido de aspirina foi de
I. o aumento da concentração dos reagentes diminui a velocidade da reação.
II. quanto maior a área de contato entre as fases dos reagentes, maior será a velocidade da reação.
III. quanto maior a energia de ativação, mais lenta será a reação.
IV. o aumento da temperatura do sistema diminui a velocidade da reação.
V. o uso de catalisador diminui a energia de ativação e, portanto, aumenta a velocidade de uma reação.
Assinale a alternativa CORRETA.
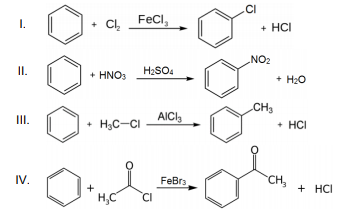
A partir da análise das reações apresentadas, assinale a alternativa CORRETA.
INSTRUÇÃO: Responder à questão com base na figura a seguir, a qual representa um segmento hipotético de proteína. A estrutura primária (sequência de aminoácidos) está representada de forma simplificada através da linha cinza.

INSTRUÇÃO: Responder à questão com base na figura a seguir, a qual representa um segmento hipotético de proteína. A estrutura primária (sequência de aminoácidos) está representada de forma simplificada através da linha cinza.

Considere as reações 1 e 2 abaixo:
(Reação 1) 6 CO2 + 6 H2O + Energia → C6 H12O6 + 6 O2
(Reação 2) C6 H12O6 + 6 O2 → 6 CO2 + 6 H2 O + Energia
Com relação às reações apresentadas, é INCORRETO afirmar que
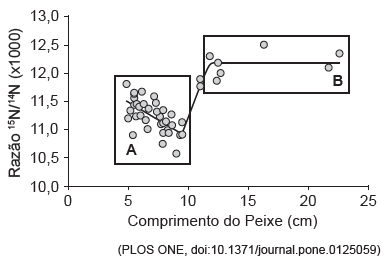
Com base nas informações do texto e na figura, considere as afirmativas:
I. Ao longo do crescimento, entre 5 e 10 cm de comprimento (fase A), a manjuba incorpora gradativamente mais alimentos de níveis tróficos superiores. II. Animais maiores (fase B) apresentam estabilidade na razão 15N/14N, sugerindo constância de dieta alimentar. III. Animais maiores (fase B) alimentam-se de uma quantidade maior de consumidores e/ou de consumidores de maior ordem, em comparação aos animais menores (fase A).
Está/Estão corretas(s) apenas a(s) afirmativa(s)
A partir do texto, são feitas as seguintes afirmativas:
I. A batata inglesa é uma eudicotiledônea em que os tubérculos são porções de caules subterrâneos transformados. II. Uma parte da molécula de solanina é composta por carboidratos. III. A fórmula estrutural da solanina (C45H73NO15) apresenta ligações covalentes entre seus átomos.
Estão corretas as afirmativas
Atualmente o cloreto de hidrogênio pode ser obtido por reação direta dos gases hidrogênio molecular e cloro molecular em uma câmara de combustão especial. O gás cloreto de hidrogênio é muito solúvel em água, e soluções aquosas de HCl são comercializadas como ácido clorídrico. A decapagem do aço é uma atividade em que se emprega o ácido clorídrico. Trata-se da remoção de óxidos, como, por exemplo, o óxido de ferro(III), da superfície do aço após o processo de laminação das chapas de aço. A decapagem ocorre pela ação de uma solução ácida diluída entre as temperaturas de 80ºC e 90ºC.
Considerando as informações do texto, é correto afirmar que
 http://www.repositorio.ufc.br/handle/riufc/10824
(Acessado em 16/05/2017)
http://www.repositorio.ufc.br/handle/riufc/10824
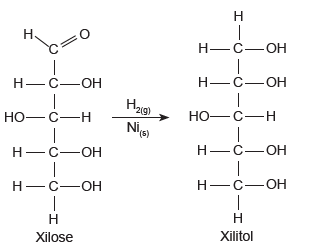
(Acessado em 16/05/2017) Na conversão da xilose em xilitol, o grupo funcional _________ se transforma em _________, de modo que um átomo de carbono modifica seu estado de oxidação de _________ para _________.
As palavras que completam corretamente as lacunas, na ordem em que se encontram, são:
O dióxido de enxofre (SO2), produto da combustão do carvão em centrais termoelétricas, é o mais importante precursor da chuva ácida, ocasionando impacto nas florestas, pastos, lavouras, ambientes aquáticos e afetando o solo. Uma tecnologia de dessulfurização de gás de chaminé, para limitar a emissão de SO2, utiliza o CaCO3 como adsorvente deste gás e gera o gesso (sulfato de cálcio). Segundo dados do IPCC2006 (Intergovernmental Panel on Climate Change), no mundo, aproximadamente 1012 g de SO2 deixam de ser emitidos por ano devido à utilização de tecnologias de dessulfurização dos gases de exaustão após combustão do carvão. Considerando que toda tecnologia de dessulfurização empregue carbonato de cálcio, a massa de gesso produzida em um ano, a partir do consumo de 1012 g de SO2 , com rendimento de 100%, de acordo com a equação química a seguir, é de aproximadamente
2 CaCO3(s) + 2 SO2(g) + O2(g) → 2 CaSO4(g) + 2 CO2(g)
A maior parte da energia de que o nosso corpo necessita vem da combustão de carboidratos por meio da respiração celular. O corpo utiliza a energia para contrair os músculos, construir e reparar os tecidos e manter a temperatura corporal. O excesso é armazenado como gordura, reserva de energia para o corpo. A composição de óleos e gorduras, de origem animal ou vegetal, comumente indicados nas embalagens dos alimentos, é expressa como “gorduras”. Um tipo de óleo vegetal geralmente usado pela população é o óleo de soja. Considere a fórmula do óleo de soja como sendo C56H100O6 (massa molar = 868 g/mol) e os dados da tabela a seguir:
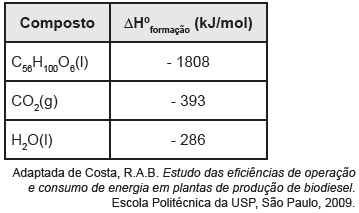
A partir dos dados, conclui-se que a energia liberada
na combustão completa de 1g do referido óleo de soja
é de aproximadamente
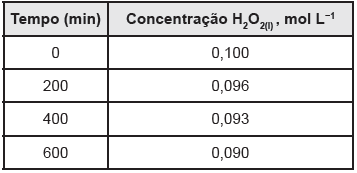
Com base nos dados da tabela, podemos concluir que, nos 200 min iniciais de reação, a velocidade de desaparecimento de H2 O2 (mol L−1 min−1) será de aproximadamente
O metal alumínio (Al) é largamente usado na produção de latinhas de refrigerante e cerveja, janelas e portas, papel alumínio, etc. Industrialmente, o alumínio é obtido através da eletrólise ígnea do óxido de alumínio extraído do minério bauxita. No processo são usados eletrodos de grafite (C), que são gastos durante a eletrólise e substituídos por novos eletrodos a cada 20 dias aproximadamente. O uso dos eletrodos de grafite gera um subproduto que acarreta intensificação do efeito estufa da atmosfera terrestre.
Com base no texto, são feitas as seguintes afirmativas:
I. A fórmula do óxido de alumínio é Al3 O2 .
II. O alumínio metálico é formado no ânodo da célula eletrolítica.
III. O subproduto que causa problemas ambientais é o dióxido de carbono.
Está/Estão correta(s) apenas a(s) afirmativa(s)
“Os íons de metais alcalinos têm importantes funções no nosso organismo, tais como influenciar em contrações musculares e pressão arterial, manter a pressão osmótica dentro das células e influenciar a condução dos impulsos nervosos. A diferença nas concentrações totais de íon de metais alcalinos dentro e fora da célula produz um potencial elétrico pela membrana celular, responsável, por exemplo, pela geração de sinais elétricos rítmicos no coração. As concentrações de Na+ e K+ nas células sanguíneas vermelhas são de 0,253 g.L−1 e de 3,588 g.L−1, respectivamente”.
Rayner-Canham, G.; Overton, T.
Química Inorgânica Descritiva. LTC.
As concentrações aproximadas desses íons, em
mol L−1, são respectivamente