Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Várias frutas, como banana, abacate e maçã, tornam-se escurecidas depois de cortadas ou descascadas. Esse fenômeno se deve à presença da substância orto-hidroquinona, que reage com o oxigênio atmosférico produzindo a ortobenzoquinona, que tem coloração marrom.
A reação química mencionada é classificada como
Alguns produtos usados no branqueamento dos dentes contêm ureia (NH2CONH2) e peróxido de hidrogênio (H2O2), cujas fórmulas estruturais estão desenhadas.

O peróxido de hidrogênio, composto bastante reativo, é o princípio ativo desse clareador, sendo estabilizado pela ureia.
KOTZ, J. C.; TREICHEL, P. M; WEAVER, G. C.
Química geral e reações químicas.
São Paulo: Cengage Learning, 2009 (adaptado).
O princípio ativo é estabilizado por interações
do tipo
O ácido oxálico (H2C2O4) está presente em caules e folhas de vegetais como o espinafre e a beterraba. Uma maneira de quantificar a concentração de ácido oxálico nos vegetais é através da titulação com hidróxido de sódio (NaOH). Para realizar uma titulação, pretende-se escolher um indicador adequado para o ponto de equivalência mostrado no gráfico. O quadro apresenta os indicadores disponíveis no laboratório.

É comum a reutilização de garrafas transparentes do tipo PET (polietileno tereftalato) para acondicionar água sanitária “caseira”. A venda clandestina desse alvejante, por ter a eficiência do cloro ativo duvidosa, pode trazer riscos à saúde, em relação ao alvejante que é vendido nos supermercados em garrafas escuras.
Disponível em: www.inmetro.gov.br. Acesso em: 6 abr. 2011 (adaptado).
As substâncias nitrogenadas desempenham importante papel em nossa sociedade. Dentre as de maior importância estão a amônia e o ácido nítrico, usadas na fabricação do náilon e do poliuretano. A conversão de NH3 em NO com o uso de catalisador é o primeiro passo para a fabricação industrial do ácido nítrico e a rota industrial para a obtenção de substâncias oxigenadas do nitrogênio. A reação de produção de NO a partir de NH3 é:
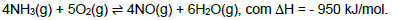
Quando a reação atinge o equilíbrio, uma maneira de aumentar a produção de NO(g) é aumentando a(o)
Flavonóides são uma classe de metabólitos secundários comumente encontrados em diversos alimentos derivados de vegetais e frutos como maçãs, nozes, frutas vermelhas, chás, brócolis e vinho tinto. Dentre os flavonóides mais encontrados em vegetais tem-se a quercetina, miricetina e kaempferol (Figura 1):
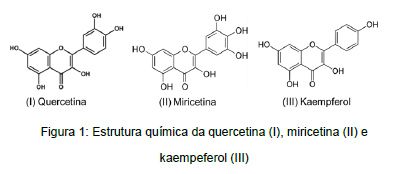
Sobre os flavonóides mencionados é INCORRETO afirmar que:
Quando zinco (Zn) metálico é colocado em contato com ácido clorídrico (HCl) ocorre uma reação de oxirredução com liberação de gás hidrogênio (H2) conforme representado pela reação a seguir:
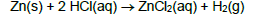
Se 10,00 g de Zn foram misturados com 8,00 g de ácido clorídrico, quantos mols de H2 foram liberados aproximadamente:
(Dados: massa molar do cromo = 52,00 g.mol-1 e constante de Faraday = 96500 C/mol).
Com relação a esse processo assinale a alternativa INCORRETA.
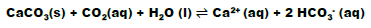
Analise as afirmativas sobre o sistema no equilíbrio e marque a alternativa CORRETA.
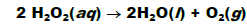
Na presença do íon brometo (Br- ), a decomposição ocorre rapidamente segundo as reações:
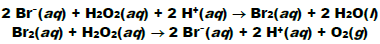
As reações vistas podem ser demonstradas graficamente a partir de um diagrama de energia potencial:
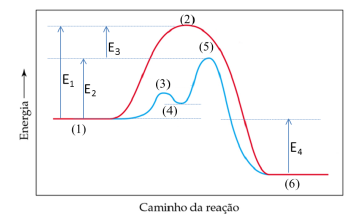
Em relação à decomposição do H2O2:
I. A reação sem catalisador acontece em apenas uma etapa e a reação com catalisador acontece em duas etapas, porém o produto formado é exatamente o mesmo.
II. E1 é a energia de ativação referente à decomposição do H2O2 na ausência de catalisador e E3 é a energia de ativação referente à decomposição do H2O2 na presença de catalisador. III. E2 é a energia de ativação da etapa determinante da velocidade da reação catalisada pelo íon Br- .
IV. E4 é a variação de entalpia da reação, que é endotérmica.
V. No gráfico, os pontos identificados por (2), (3) e (5) correspondem à energia dos complexos ativados para as reações representadas.
Assinale a alternativa CORRETA.
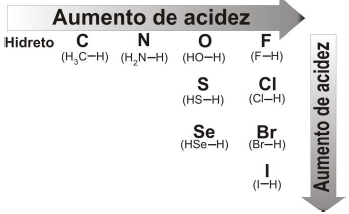
Analise os dados apresentados na figura e assinale a alternativa CORRETA.
Analise as afirmativas e assinale a alternativa CORRETA.
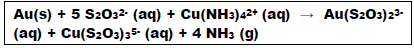
Analise as afirmativas em relação às informações:
I. Na reação demonstrada, o ouro é o agente redutor e o tiossulfato o agente oxidante.
II. É possível afirmar que são descartados anualmente 12 mil toneladas de ouro no lixo eletrônico.
III. A massa de material não metálico descartado anualmente é 1.000 vezes superior à massa de ouro descartada no mesmo período.
IV. Um volume de 14 milhões de metros cúbicos (m3 ) de materiais não metálicos são descartados anualmente no lixo eletrônico.
V. Seriam necessários 6,82 mil toneladas de tiossulfato para tratar a massa de ouro descartada no lixo eletrônico.
Assinale a alternativa CORRETA.
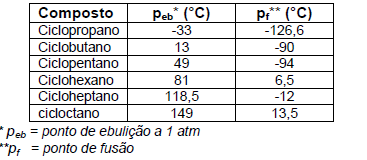
Com relação aos compostos apresentados na tabela, assinale a alternativa INCORRETA.
Analise as afirmativas a seguir em relação aos números quânticos:
I. o número quântico principal corresponde aos níveis de energia do elétron e também é chamado por uma letra de acordo com o nível (K, L, M...).
II. os elementos representativos na tabela periódica possuem sua distribuição eletrônica terminando nos subníveis s e p, enquanto os elementos de transição interna terminam sua distribuição eletrônica no subnível d e os elementos de transição completam sua distribuição eletrônica no subnível f .
III. o número quântico de spin descreve o momento magnético do elétron.
IV. o número quântico magnético descreve o orbital e é a causa do ferromagnetismo das substâncias.
V. os quatro números quânticos somente assumem valores inteiros.
Assinale a alternativa CORRETA.