Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
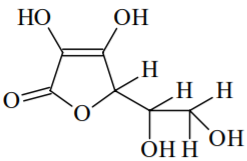 Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto.
Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto. A ingestão diária de vitamina C feita por Linus Pauling aproximava-se a 1.000 vezes do valor recomendado.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
 Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto.
Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto. A molécula de vitamina C pode ser hidrolisada em meio ácido, convertendo sua função lactona para ácido carboxílico e álcool.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
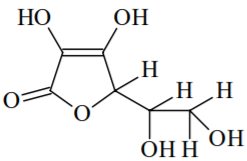 Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto.
Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto. Em um mol de moléculas de vitamina C, encontramos 6 mols de átomos de carbono.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
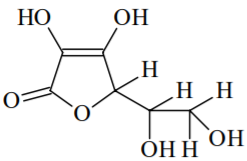
Linus Pauling, ganhador dos prêmios Nobel de Química e da Paz, ingeria diariamente entre 4 e 6 gramas dessa vitamina, por acreditar nos seus efeitos terapêuticos. No entanto, recomenda-se somente a ingestão diária de 3,5 x 10-4 mol dessa vitamina. Sobre essas informações, assinale o que for correto.
A vitamina C é lipossolúvel.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A reação 2B2O3(S) + 2H2O(l) ==> 4HBO2(aq) é endotérmica.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A formação de 352 g de HBO2, a partir de H2B4O7 e água, produz um ∆H de -29,0 kJ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
O ∆H para a reação 2H2B4O7(aq) + 10H2O(l) ==> 8H3BO3(aq) é igual a -10,6 kJ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
A Lei de Hess diz que a variação de entalpia em uma reação depende apenas do estado final da reação.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
H3BO3(aq) ==> HBO2(aq) + H2O(l) ∆H = -2,30 kJ H2B4O7(aq) + H2O(l) ==> 4HBO2(aq) ∆H = -14,5 kJ H2B4O7(aq) ==> 2B2O3(s) + H2O(l) ∆H = +22,7 kJ
O ∆H para a reação 2H3BO3(aq) ==> B2O3(s) + 3H2O(l) é igual a 14,0 kJ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Um dos hidrocarbonetos componentes da gasolina, o 2,2,4-trimetilpentano, pode ser classificado com um hidrocarboneto ramificado, saturado e alifático.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
O teste pode também ser usado para identificar a presença de solventes adulterantes da gasolina, como o tolueno.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Se a mistura for deixada em repouso após sua agitação e for observada uma separação em duas fases, com volume de 60 mℓ na fase aquosa e 40 mℓ na fase orgânica, a gasolina possui 10% de etanol.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
As interações intermoleculares de ligação de hidrogênio entre as moléculas de água e etanol são muito mais fortes que as interações intermoleculares entre etanol e gasolina.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
A mistura final obtida é heterogênea e apresenta 3 fases distintas.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
O número de oxidação do enxofre no Al2(SO4)3 é igual a + 4.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
Em meio mol do sal, existem 2 mols de átomos de alumínio.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
3 mols de ácido reagem com 12,04 x 1023 moléculas de base.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
O coeficiente “x” é igual a 6.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
Ao se reagir 156 g da base, irá se formar 342 g do sal.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Os balões utilizados na prática de balonismo esportivo alçam vôo devido à queima de gás butano, que causa o aquecimento dos gases do interior do balão, fazendo com que esses gases se tornem menos densos que o ar.