Questões de Vestibular
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 233 questões
Considerando-se que, no equilíbrio, [H3AsO3] = 7 × 10−3 mol/L, [Fe2+] = [H3AsO4] = 2,1 × 10−3 mol/L e que a constante de equilíbrio da reação em apreço seja igual a 3 × 107 , é correto inferir que, em pH 7, a concentração do íon Fe3+ é superior a 3 × 10−14 mol/L.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Conforme o princípio de Le Châtelier, caso a reação esteja em equilíbrio, um aumento na concentração de amônia deslocaria o equilíbrio no sentido da formação do complexo.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
O valor da constante de equilíbrio da reação em apreço indica que a decomposição do complexo [Co(NH3)6] 2+ é favorecida.
Co2+ (aq) + 6 NH3 (aq) ⇌ [Co(NH3)6] 2+ (aq)
Considerando que a constante de Avogadro seja igual a 6,02 × 1023 mol−1, julgue o item.
Considere que, para a preparação do complexo, seja utilizada uma solução de cloreto de cobalto (II) anidro (CoCl2). Nesse caso, a relação entre o produto de solubilidade (Kps) do CoCl2 e sua solubilidade molar (cs) seriam corretamente representados por
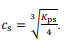
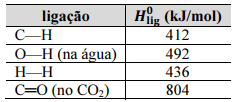
Assinale a opção em que são apresentadas duas ações que, do ponto de vista do equilíbrio químico, favorecem a conversão do metano no processo de sua reforma a vapor.
aumento da temperatura e redução da pressão do sistema
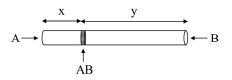
Em um experimento realizado por Thomas Graham, dois gases A e B foram liberados simultaneamente nas extremidades de um tubo de vidro; esses gases difundiram-se em direção ao centro do tubo e, no instante em que se encontraram, formaram um anel de um composto AB, como mostra a figura a seguir.
Para esses gases A e B, de massas molares MA e MB, respectivamente, verifica-se o seguinte postulado de Graham, em que vB representa a velocidade de difusão de B e vA, a velocidade de difusão de A.
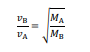
Tendo como referência essas informações e considerando que MA = 4MB, julgue o item.
Considere que o gás cloreto de hidrogênio (HCl) possa
ser obtido a partir dos gases hidrogênio (H2) e cloro (Cl2)
por meio da reação reversível H2(g) + Cl2(g) ⇌ 2 HCl(g) e que
um frasco fechado, a uma dada temperatura, contenha
esses três gases em equilíbrio, com 20% de H2 e 60% de
Cl2 em volume, a uma pressão total de 10 atm. Nessas
condições, a constante de equilíbrio, no que se refere à
pressão, é superior a 0,25.
A produção mundial de ácido cítrico é de aproximadamente 63,5 milhões de quilogramas por ano, sendo esse ácido orgânico produzido pela fermentação aeróbica da sacarose (C12H22O11) por uma cultura pura do fungo filamentoso Aspergillus niger, de acordo com a reação global representada a seguir.
C12H22O11 + 3 O2 → 2 C6H8O7 + 3 H2O
Considerando as informações anteriores, julgue o item.
Caso a reação em apreço seja reversível e esteja sujeita às
leis do equilíbrio químico, um ambiente anaeróbico
favoreceria a produção de ácido cítrico.
N2 O4 (g) ⇌ 2 NO2 (g)
A partir de um experimento, foram registradas as variações das concentrações desses óxidos em função do tempo. Observe o gráfico:
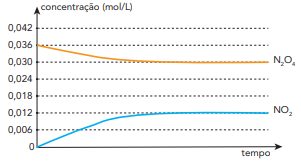
Com base nos dados obtidos, o valor da constante de equilíbrio em função das concentrações é igual a:
HbH+ (aq) + O2(g) ⇌ HbO2(aq) + H+ (aq)
O dióxido de carbono liberado na respiração pode alterar esse equilíbrio devido à formação de ácido carbônico, representado pela equação:
CO2(g) + H2O(l) ⇌ H+ (aq) + HCO3 − (aq)
Com base nessas informações, é correto afirmar:
DADOS QUE PODEM SER USADOS NESTA PROVA

N2(g) + 3H2(g) ⇌ 2NH3(g) ∆H° = -92,6 KJ.mol-1
Um aluno, analisando a equação fornecida, fez as seguintes afirmações:
I - É possível maximizar a produção de amoníaco se a reação ocorrer a pressões elevadas. II - Dada a natureza exotérmica da reação direta, quanto menor a temperatura do vaso reacional, maior será a produção de amoníaco.
A alternativa CORRETA é:
Para estudar equilíbrio químico de íons Co2+ em solução, uma turma de estudantes realizou uma série de experimentos explorando a seguinte reação:
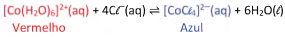
Nesse equilíbrio, o composto de cobalto com água, [Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o composto com cloretos, [CoCl4]2-(aq), possui coloração azul.
Para verificar o efeito de ânions de diferentes sais nessa mudança de cor, 7 ensaios diferentes foram realizados. Aos tubos contendo apenas alguns mL de uma solução de nitrato de cobalto II, de coloração vermelha, foram adicionadas pequenas quantidades de diferentes sais em cada tubo, como apresentado na tabela, com exceção do ensaio 1, no qual nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um tempo, e a cor final foi observada.
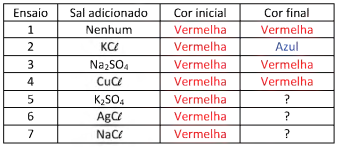
A alternativa que representa a cor final observada nos ensaios 5, 6 e 7, respectivamente, é:
Note e adote:
Solubilidade dos sais em g/100 mL de água a 20 °C
AgCℓ 1,9 x 10-4 NaCℓ 35,9
CuCℓ 9,9 x 10-3 Na2SO4 13,9
KCℓ 34,2 K2SO4 11,1
2ClO (g) ⇌ (ClO)2 (g)
Os dados de reações de dimerização do gás monóxido de cloro em diferentes temperaturas estão indicados na tabela.
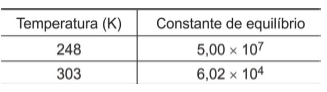
O processo de dimerização do gás monóxido de cloro é
2 CO (g) + O2 (g) ⇋ 2 C02 (g)
Em um determinado recipiente, contendo inicialmente monóxido de carbono e oxigênio, estabeleceuse um equilíbrio em que se pode determinar a pressão total da mistura, 6,1 atm, e as pressões parciais de monóxido de carbono e de dióxido de carbono, as quais foram, respectivamente, 0,5 atm e 4,0 atm.
O valor da constante de equilíbrio será igual a
H2(g) ⇋ 2 H (g)
Sobre essa reação, são feitas as seguintes afirmações.
I - A quantidade de hidrogênio atômico aumenta com o aumento da temperatura, porque a reação é endotérmica. II - Em condições de baixa temperatura, não há energia suficiente para romper a ligação. III- A variação de entalpia envolvida na reação é o dobro da entalpia de formação do hidrogênio atômico nas condições da reação.
Quais estão corretas?
2 NO2(g) ⇄ N2O4(g)
O sistema estará fora do equilíbrio químico, se essa reação ocorrer
3 O2(g) ⇄ 2 O3(g).
À medida que o oxigênio se transforma em ozônio, a pressão interna dos gases dentro do recipiente diminuiu. Isso ocorre devido à diminuição do número de moléculas. Quando o equilíbrio químico é atingido, a pressão fica constante.
Depois de atingido o equilíbrio, se a pressão do sistema for aumentada, o equilíbrio químico se
O uso do ácido acetil salicílico como princípio ativo de medicamentos analgésicos é bastante comum. Ao ser ingerida, essa substância se dissocia no estômago, em uma reação que apresenta equilíbrio químico. A equação abaixo representa a reação de dissociação do ácido acetil salicílico, cuja fórmula é representada de forma simplificada por HAs.
HAs(aq) ⇌ H+ (aq) + As- (aq).
O organismo humano absorve apenas a forma dissociada dessa substância, sendo o íon As- o responsável pelo efeito analgésico.
O procedimento que acelera a absorção do medicamento pelo organismo é
Um refrigerante é uma solução homogênea e líquida enquanto está contido em um frasco fechado. Quando se abre esse frasco, bolhas de gás surgem imediatamente, emergindo do líquido para a superfície. Esse gás é o dióxido de carbono que interage com a água segundo o equilíbrio:
CO2 (g) + H2O (l) ⇆ H2CO3 (aq).A opção que apresenta, corretamente, o deslocamento do equilíbrio da reação representada
é:

