Questões de Vestibular
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 233 questões
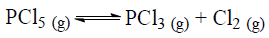
As concentrações de PCl3 e Cl2 são 0,01 mol/L e 0,30 mol/L, respectivamente. Sabendo que Kc = 0,006 na mesma temperatura, calcule a concentração de PCl 5 nesse equilíbrio.
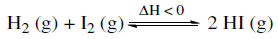
De acordo com o princípio de Le Chatelier, indique a alternativa que aponta uma maneira de o equilíbrio acima ser deslocado no sentido de produzir uma maior quantidade do produto.
A partir de um sistema inicialmente em equilíbrio e segundo o princípio de Le Chatelier é correto afirmar que
A2(g) + B2(g)
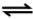 2 AB(g)
2 AB(g)
Considerando-se que, no estado de equilíbrio químico, a concentração da espécie AB(g) seja de 0,1 mol·L-1, a constante de equilíbrio (KC), para esse processo, é aproximadamente igual a
CO2(aq) + H2O(l) ⇌ H2CO3(aq) ⇌ H 1+ (aq) + HCO3- (aq)
Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o HCO3- (aq) e o H2CO3(aq) é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao organismo, devido às alterações metabólicas, podendo causar a morte.
Levando em conta as informações acima, é correto afirmar que
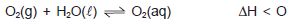
A dissolução de oxigênio do ar atmosférico na água é de fundamental importância para manutenção de seres vivos nos oceanos, rios e lagos. Assim, algumas espécies de peixes, por necessitarem de taxas relativamente elevadas de oxigênio dissolvido, O2(aq), são, para a sobrevivência, atendidas. O processo de dissolução pode ser representado pelo sistema em equilíbrio químico no destaque.
Com base nas informações do texto e do sistema em equilíbrio químico, marque com V as proposições verdadeiras e com F, as falsas.
( ) As concentrações de oxigênio dissolvido, à baixa temperatura nas águas dos lagos, nos Andes, é maior do que nas lagoas
e nos rios, no litoral do Nordeste.
( ) As chances de sobrevivência de peixes de águas frias, em altitudes elevadas, é bem maior que na lagoa Rodrigo de Freitas,
no Rio de Janeiro.
( ) A solubilidade de oxigênio na água salgada é muito maior do que nos rios e lagos ao nível do mar.
A alternativa que contém a sequência correta, de cima para baixo, é a
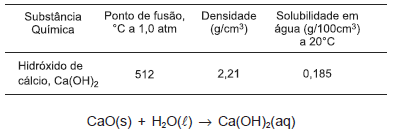
O hidróxido de cálcio, conhecido como cal hidratada ou extinta, é um sólido branco pouco solúvel em água, utilizado na preparação de argamassa e na pintura de paredes. No tratamento de água e de esgotos, participa como regulador de pH e floculante.
Considerando-se as informações da tabela, da equação química e do texto, é correto afirmar:
Sobre equilíbrio químico, são dadas as seguintes informações:
I. O grau de equilíbrio consiste na razão entre o número de mols consumidos de um certo reagente e seu número de mols inicial.
II. Na constante de equilíbrio da concentração molar (Kc) devem ser representados os componentes sólidos.
III. Na constante de equilíbrio em termos das pressões parciais dos gases(Kp), só devem ser representados os componentes gasosos
IV. De acordo com o Princípio de Le Chatelier, o aumento de pressão, o equilíbrio se desloca para o lado de menor volume (menor número de mols), a diminuição da temperatura, desloca o equilíbrio no sentido da reação exotérmica e catalisadores deslocam o equilíbrio.
Indique a opção correta:
Por ser uma solução em que o principal soluto é gás carbônico, quem já tomou água com gás experimentou um sabor diferente, um pouco picante. Nela acontece o seguinte equilíbrio químico:
CO2 (g) + H2O(l) H2 CO3 (aq)
Sobre a água com gás e o equilíbrio apresentado, podemos afirmar que:
Sobre esse processo, é correto afirmar:
AAS (s) + H2O (l) ⇄ AAS‾ (aq) + H3O+ (aq)
Assim, quando se toma um medicamento que contém o AAS com um pouco de água, a maior parte do medicamento encontra-se na forma ionizada (AAS‾ ) e nesta forma ela não atravessa a camada protetora das paredes do estômago. A forma neutra (AAS) pode atravessar as paredes do estômago causando hemorragia em algumas pessoas ou outras complicações médicas.
Sobre o equilíbrio químico do AAS em nosso organismo, é CORRETO afirmar que:
O “galinho do tempo” é um objeto típico de Portugal muito vendido como lembrança desse país. Esse souvenir muda de cor reversivelmente entre rosa e azul, de acordo com a variação climática do local (temperatura e umidade do ar), devido à presença do composto químico cloreto de cobalto nesse objeto. A reação química que ocorre é demonstrada pela equação química abaixo:
Considerando o equilíbrio químico envolvido na reação química que ocorre no “galinho do tempo”, analise as proposições.
I. Quando a temperatura do local onde o “galinho do tempo” se encontra for elevada, a coloração dele será azul.
II. O “galinho do tempo” apresentará coloração rosa quando a umidade do ar for elevada.
III. Em dias frios e chuvosos, a coloração do “galinho do tempo” será rosa.
Assinale a alternativa correta
N2(g) + 3 H2(g) ⇋ 2 NH3(g) ∆H < 0
Assinale a alternativa a seguir correspondente à ação que aumentaria a concentração da amônia:
Em se tratando de equilíbrio químico, uma série de fatores pode alterar o sistema reacional. Entre os principais parâmetros, destaca-se o aumento ou a diminuição da concentração dos reagentes e dos produtos de uma reação. Com base na equação da formação de cloreto de hidrogênio gasoso (HCl(g)), o que acontece com o equilíbrio químico se a concentração de H(g) e Cl(g) for aumentada?
H2(g) + Cl2(g) → 2HCl(g) (∆Hƒº= -92,3 kJ/mol)
As cavernas são formadas pela dissolução de carbonato de cálcio (CaCO3) em água. Esse sal é muito comum na natureza e pode ser encontrado em grande quantidade na constituição do calcário. Ele não é muito solúvel em água; no entanto, quando está na presença de dióxido de carbono (gás carbônico – CO2) e sendo submetido a altas pressões, o carbonato de cálcio se solubiliza bem na água. As águas subterrâneas se encontram exatamente nessas condições, isto é, com grande quantidade de gás carbônico dissolvido e a elevadas pressões. Assim, quando as águas subterrâneas passam por terrenos contendo calcário, ocorre a dissolução do carbonato de cálcio, conforme pode ser representado pela seguinte equação química:
CaCO3(s) + CO2(g) + H2O(ℓ) → Ca2+(aq) + 2HCO-3(aq) ΔH < 0
Entretanto, essa reação também pode ocorrer no sentido inverso, resultando na formação do calcário. Isso acontece, por exemplo, quando essas águas ficam no teto das cavernas e vão gotejando muito lentamente. Dessa forma, a água vai evaporando e também há a liberação do CO2(g), e o carbonato vai se depositando na forma de estalactites no teto e estalagmites no chão das cavernas.
Ca2+(aq) + 2 HCO-3(aq) → CaCO3(s) + CO2(g) + H2O(ℓ) ΔH > 0
Disponível em:<http://mundoeducacao.bol.uol.com.br/quimica/formacaoconstituicao-estalactites-estalagmites.htm> . Acesso em: 29 de julho de 2016.
2HI(g) ⇌ H2(g) + I2(g) ΔH° = − 53kJ
Uma análise dessas informações permite afirmar:
Em um recipiente aberto, a água evapora até o fim, na temperatura e pressão ambiente. Entretanto, quando o recipiente é fechado, as moléculas de água são impedidas de escapar, ocorrendo, então, um equilíbrio de evaporação entre água líquida e vapor, a 25o°C e 1,0atm. Uma análise dessas informações permite corretamente concluir:
A hemoglobina (Hb) é a proteína responsável pelo transporte de oxigênio. Nesse processo, a hemoglobina se transforma em oxihemoglobina (Hb(O2)n). Nos fetos, há um tipo de hemoglobina diferente da do adulto, chamada de hemoglobina fetal. O transporte de oxigênio pode ser representado pelo seguinte equilíbrio:
Hb + nO2 ⇌ Hb(O2)n ,
em que Hb representa tanto a hemoglobina do adulto quanto a hemoglobina fetal. A figura mostra a porcentagem de saturação de Hb por O2 em função da pressão parcial de oxigênio no sangue humano, em determinado pH e em determinada temperatura.
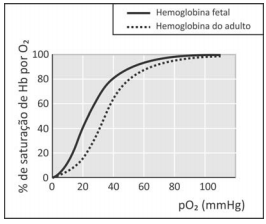
A porcentagem de saturação pode ser entendida como:
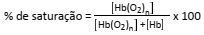
Com base nessas informações, um estudante fez as seguintes afirmações:
I. Para uma pressão parcial de O2 de 30 mmHg, a hemoglobina fetal transporta mais oxigênio do que a hemoglobina do adulto.
II. Considerando o equilíbrio de transporte de oxigênio, no caso de um adulto viajar do litoral para um local de grande altitude, a concentração de Hb em seu sangue deverá aumentar, após certo tempo, para que a concentração de Hb(O2)n seja mantida.
III. Nos adultos, a concentração de hemoglobina associada a oxigênio é menor no pulmão do que nos tecidos.
É correto apenas o que o estudante afirmou em
Note e adote:
pO2 (pulmão) > pO2 (tecidos).
[PCl5] = 1,5 mol/L, [Cl2] = 0,3 mol/L
A concentração molar de PCl3 no equilíbrio é :
