Questões de Vestibular
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 234 questões
C (s) + CO2 (g) ⇌ 2CO (g) ; ∆H = +88 kJ / mol de CO (g)
O rendimento em CO (g) desse equilíbrio aumenta com o aumento da , com a diminuição da e não se altera pela adição de .
As lacunas do texto são, correta e respectivamente, preenchidas por:
N2(g) + 3 H2(g)
Com o intuito de favorecer a produção de amônia, foram feitas, no sistema, as intervenções de I a V.
I. Aumento da pressão total do sistema.
II. Aumento da pressão parcial do gás amônia.
III. Diminuição da concentração do gás hidrogênio.
IV. Aumento da concentração do gás nitrogênio.
V. Utilização de um catalisador de ferro metálico.
São eficientes, para esse propósito, apenas as intervenções
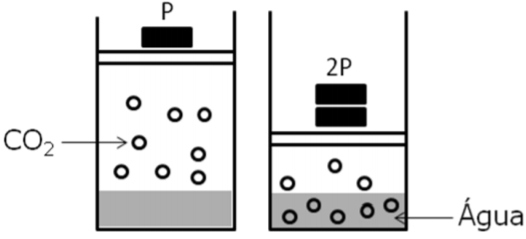
No champanhe, nos vinhos espumantes e nas cervejas, o dióxido de carbono (CO2) é o principal responsável pela formação das bolhas, originadas quando o levedo fermenta os açúcares, convertendo-os em moléculas de álcool e de CO2.
Após o engarrafamento, é estabelecido um equilíbrio entre o gás carbônico dissolvido no líquido e o gás que está no espaço sob a rolha ou a tampa.
Considerando as informações do texto, os seus conhecimentos químicos e a figura dada, é INCORRETO afirmar que
2 SO2(g) + O2(g) ⇌2 SO3(g)
Sabendo que, reagindo 12 mols de SO2 e 12 mols de O2 foram produzidos 8 mols do SO3 em um recipiente de 1,0 L, qual a constante de equilíbrio da reação (Kc)?
NaHCO3(aq) + HCl(aq) → NaCl(aq) + H2CO3(aq) H2CO3(aq)
 H2O(l) + CO2(g)
H2O(l) + CO2(g)
Com relação às reações acima, três afirmações foram feitas:
1) O NaHCO3 é uma base que reage com HCl para gerar um novo ácido, o ácido carbônico.
2) O aumento da quantidade de H2CO3 no estômago desloca o equilíbrio para a formação de CO2, que explica o alívio e liberação de gás do estômago.
3) Quando tomamos NaHCO3 o pH do estômago aumenta.
Está(ão) correta(s) a(s) afirmativa(s):
CO(g) + 2 H2(g)
 CH3OH(g)
CH3OH(g)
Com relação a esse equilíbrio, três afirmações foram feitas:
1) A formação de metanol é favorecida pela remoção de CO.
2) O aumento da pressão não influencia o equilíbrio.
3) A adição de gás hidrogênio favorece a formação de metanol.
Está(ão) correta(s) a(s) afirmativa(s):
N2O(g) ⇄ N2(g) + ½O2(g) ∆Ho = – 68 kJ
Com relação à reação citada acima, três afirmações foram feitas:
1) O aumento da temperatura desloca o equilíbrio no sentido dos reagentes. 2) A reação acima é endotérmica. 3) Diminuindo-se a concentração de N2O, o equilíbrio é deslocado no sentido dos reagentes.
Está(ão) corretas:
Considere a reação química que ocorre dentro de um recipiente fechado, à temperatura constante, e o gráfico com os valores das concentrações de estado de equilíbrio químico das espécies participantes.
H2
(g) + Cℓ2
(g) 2HCℓ (g)
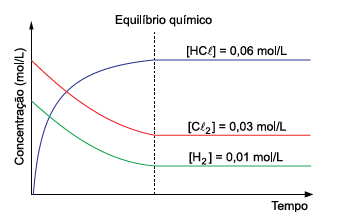
Considerando os dados da reação e do gráfico, pode-se concluir que o valor da constante de equilíbrio químico (Kc
) para
essa reação é
O processo de desenvenenamento da mandioca inicia-se pela imersão da raiz da planta em um tanque com água durante a noite ou por alguns dias, até que comece uma leve fermentação ácida, o que faz baixar o valor do pH da água, criando-se um ambiente que intensifica a atividade de uma enzima já existente na planta. Com a diminuição do pH, o ácido cianídrico (HCN) permanece indissociado e é removido do líquido.
(Adaptado de J. Soentgen e K. Hilbert, A química dos povos indígenas da América do Sul, Química Nova, v. 39, n. 9, p. 1141-1150, 2016.)
O artigo explica, do ponto de vista da Química, como
ocorre o desenvenenamento da mandioca. De acordo com
o texto, esse processo é favorecido por
Logo no início da viagem os rapazes param para almoçar. Para temperar a salada, eles se deparam com dois tipos de vinagre: um praticamente transparente (comum, com acidez 4%) e outro bastante escuro (balsâmico, com acidez 6%).
Dados sobre a fenolftaleína: incolor, pH<8; rosa, 8<pH<10; roxa, pH>10.
Sobre o assunto, é CORRETO afirmar que:
a adição de um ácido forte a uma solução de ácido etanoico desloca o equilíbrio para a
formação do ânion etanoato.
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

Com relação às informações acima, assinale a proposição CORRETA.
O dióxido de carbono pode ser formado a partir da reação do monóxido de enxofre com o oxigênio expressa pela equação não balanceada: CO(g) + O2(g) 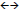 CO2(g) .Assinale a opção que representa corretamente o efeito provocado pela retirada de dióxido de carbono.
CO2(g) .Assinale a opção que representa corretamente o efeito provocado pela retirada de dióxido de carbono.
A + B ⇌ C + D
O valor numérico da constante de equilíbrio, Kc, será igual a:
O craqueamento é uma reação química empregada industrialmente para a obtenção de moléculas mais leves a partir de moléculas mais pesadas. Considere a equação termoquímica abaixo, que representa o processo utilizado em uma unidade industrial para o craqueamento de hexano.
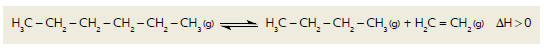
Em um experimento para avaliar a eficiência desse processo, a reação química foi iniciada sob
temperatura T1
e pressão P1
. Após seis horas, a temperatura foi elevada para T2 , mantendo-se a
pressão em P1
. Finalmente, após doze horas, a pressão foi elevada para P2 , e a temperatura foi
mantida em T2
.
A variação da concentração de hexano no meio reacional ao longo do experimento está
representada em:
O monóxido de carbono, formado na combustão incompleta em motores automotivos, é um gás extremamente tóxico. A fim de reduzir sua descarga na atmosfera, as fábricas de automóveis passaram a instalar catalisadores contendo metais de transição, como o níquel, na saída dos motores.
Observe a equação química que descreve o processo de degradação catalítica do monóxido de carbono:
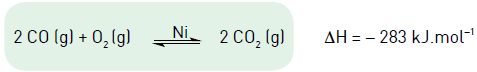
Com o objetivo de deslocar o equilíbrio dessa reação, visando a intensificar a degradação catalítica do monóxido de carbono, a alteração mais eficiente é:
O craqueamento é uma reação química empregada industrialmente para a obtenção de moléculas mais leves a partir de moléculas mais pesadas. Considere a equação termoquímica abaixo, que representa o processo utilizado em uma unidade industrial para o craqueamento de hexano.
H3C − CH2 − CH2 − CH2 − CH2 − CH3 (g) ⇌ H3C − CH2 − CH2 − CH3(g) + H2C = CH2 (g) ∆H >0
Em um experimento para avaliar a eficiência desse processo, a reação química foi iniciada sob temperatura T1 e pressão P1 . Após seis horas, a temperatura foi elevada para T2 , mantendo-se a pressão em P1 . Finalmente, após doze horas, a pressão foi elevada para P2 , e a temperatura foi mantida em T2 .
A variação da concentração de hexano no meio reacional ao longo do experimento está
representada em:
A ionização do ácido cianídrico é representada pela equação química abaixo:
HCN (aq) ⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo
grau de ionização α
constante de equilíbrio Ka
potencial hidrogeniônico pH
concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte
símbolo:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Considerando que no equilíbrio a 60 °C, a pressão parcial do tetróxido de dinitrogênio é 1,4 atm e a pressão parcial do dióxido de nitrogênio é 1,8 atm, a constante de equilíbrio Kp será, em termos aproximados,
