Questões de Vestibular
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 233 questões
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Considerando que no equilíbrio a 60 °C, a pressão parcial do tetróxido de dinitrogênio é 1,4 atm e a pressão parcial do dióxido de nitrogênio é 1,8 atm, a constante de equilíbrio Kp será, em termos aproximados,
N2(g) + 3H2(g) ⇄ 2NH3(g)
Em determinada condição de temperatura e depois de se atingir o equilíbrio, as pressões parciais de nitrogênio, hidrogênio e amônia se estabilizaram em 0,5, 1,5 e 2,0 atm, respectivamente. O valor da constante de equilíbrio Kp para esse sistema, expresso em atm-2 , é:
Sabe-se que, para esse equilíbrio, a constante Kp vale:
Kp = 1,5 x 10-3 atm-2 a 200 ºC Kp = 3,0 x 10-2 atm-2 a 300 ºC
Marque a resposta correta:
A(g) + 2B(g) ⇄ 3C(g) + 4D(l)
2SO3(g)
 2SO2(g) + O2(g)
2SO2(g) + O2(g)Assinale a alternativa que apresenta, para a reação dada, a expressão da constante de equilíbrio em termos de pressão parcial:
O eugenol, extraído de plantas, pode ser transformado em seu isômero isoeugenol, muito utilizado na indústria de perfumes. A transformação pode ser feita em solução alcoólica de KOH.
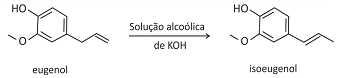
Foram feitos três experimentos de isomerização, à mesma temperatura, empregando-se massas iguais de eugenol e volumes iguais de soluções alcoólicas de KOH de diferentes concentrações. O gráfico a seguir mostra a porcentagem de conversão do eugenol em isoeugenol em função do tempo, para cada experimento.
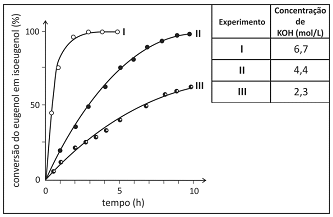
Analisando-se o gráfico, pode-se concluir corretamente que
O processo de dissolução do sulfato de sódio em água é exotérmico, conforme a equação:
Na2SO4
(s)  2 Na+(aq) + SO42–(aq) + calor.
2 Na+(aq) + SO42–(aq) + calor.
À medida que se resfria o sistema, é possível observar um deslocamento do equilíbrio em um certo sentido.
Pode-se promover deslocamento no mesmo sentido com
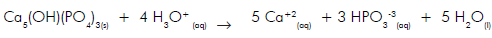
Ao adicionarmos esse fosfato natural em solos ácidos ocorrerá
A altas temperaturas, N2 reage com O2 produzindo NO, um poluente atmosférico:
N2(g) + O2(g) ⇌ 2NO(g)
À temperatura de 2000 kelvins, a constante do equilíbrio acima é igual a 4,0 x 10-4. Nesta temperatura, se as concentrações de equilíbrio de N2 e O2 forem, respectivamente, 4,0 x 10-3 e 1,0x10-3 mol/L, qual será a de NO?

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:

Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Considere o equilíbrio químico: A  2B + C e as concentrações iniciais seguintes:
2B + C e as concentrações iniciais seguintes:
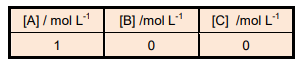
Um experimento, realizado a 25 °C, mostrou que para 1 litro de reagente o equilíbrio foi atingido quando 0,5 moles
do reagente foram consumidos. Assinale o valor da constante de equilíbrio da reação.
 2B + C apresenta, numa dada temperatura, constante de equilíbrio K = 1. A tabela abaixo
representa, sob essa mesma temperatura, concentrações de A, B e C presentes numa mistura de A, B e C.
2B + C apresenta, numa dada temperatura, constante de equilíbrio K = 1. A tabela abaixo
representa, sob essa mesma temperatura, concentrações de A, B e C presentes numa mistura de A, B e C. 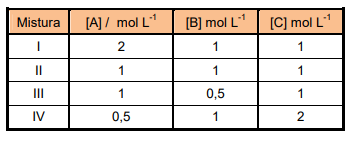
É CORRETO afirmar que está em equilíbrio a mistura:
4NH3 (g) + 5O2 (g)
 4NO (g) + 6H2O (g)
4NO (g) + 6H2O (g)  H < 0
H < 0 Qual das afirmações a seguir é INCORRETA?
Considere o processo de equilíbrio de formação do óxido de carbono:
C(s) + 1/2 O2(g) ⇄ CO(g) ∆H = -110,5 kJ mol-1
É CORRETO afirmar que:
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A adição de um catalisador na reação II, em equilíbrio, favorece o rendimento em H2
.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
Uma diminuição de pressão favorece a formação de CO2
na reação I.
I. CO(g) + 1/2 O2
(g)  CO2
(g) ΔHºr1 = – 283,00kJmol–1
CO2
(g) ΔHºr1 = – 283,00kJmol–1
II. CO(g) + H2O(g)  CO2
(g) + H2
(g) ΔHºr2
=?
CO2
(g) + H2
(g) ΔHºr2
=?
Considere as duas reações no estado gasoso e os dados termodinâmicos a 298K.
Dados termodinâmicos:
ΔHºf H2O(g) = –241,82kJmol–1
Sº H2O(g) = 188,83JK–1mol–1
Sº CO(g) = 197,65JK–1mol–1
Sº CO2(g) = 213,74JK–1mol–1
Sº H2(g) = 130,68JK–1mol–1
Sº O2(g) = 205,14JK–1mol–1
Com base nestes dados e nos conhecimentos de química, é correto afirmar:
A constante de equilíbrio para a reação II, a 298K, é 1,05.10–5.
CO2(g), dissolvido em água, H2CO3 no meio aquoso, e HCO3-, no meio aquoso, encontram-se em equilíbrio de acordo com as representações abaixo:
(I) CO2(aq) + H2O
 H2CO3 (aq)
(II) H2CO3(aq) + H2O
H2CO3 (aq)
(II) H2CO3(aq) + H2O HCO3-(aq) + H3O+(aq)
HCO3-(aq) + H3O+(aq)(III) HCO3- (aq) + H2O
 CO32-(aq) + H3O+(aq)
CO32-(aq) + H3O+(aq)Sobre esse comportamento é correto afirmar que: