Questões de Vestibular
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 233 questões
Quando se monitoram as concentrações na reação de dimerização do NO2, 2 NO2 ⇋ N2O4, obtém-se a seguinte tabela (concentrações em mol L – 1)
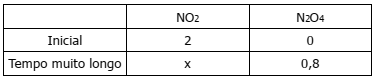
Qual o valor de x em mol L–1 e qual o valor da constante de equilíbrio em termos das
concentrações?
N2(g) + O2(g)

 2 NO(g)
2 NO(g) 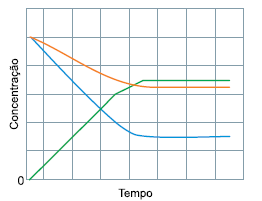
Esse gráfico está associado à seguinte reação química:
Quando a reação atinge o equilíbrio, uma maneira de aumentar a produção de NO(g) é aumentando a(o):
Ca10(PO4)6(OH)2 (s) + H+ → 10 Ca+2 (aq.) + 6 HPO4 -2 (aq.) + 2 H2O (l)
Em relação à reação de degradação da hidroxiapatita, são todas substâncias que impedem a solubilização do esmalte dentário:
N2O(g) ⇄ N2(g) + ½O2(g) ∆Ho = – 68 kJ
Com relação à reação citada acima, três afirmações foram feitas:
1) O aumento da temperatura desloca o equilíbrio no sentido dos reagentes. 2) A reação acima é endotérmica. 3) Diminuindo-se a concentração de N2O, o equilíbrio é deslocado no sentido dos reagentes.
Está(ão) corretas:
Considere a reação química que ocorre dentro de um recipiente fechado, à temperatura constante, e o gráfico com os valores das concentrações de estado de equilíbrio químico das espécies participantes.
H2
(g) + Cℓ2
(g) 2HCℓ (g)
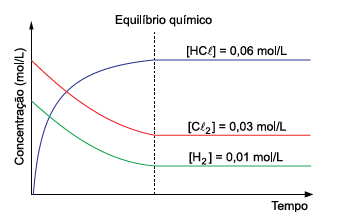
Considerando os dados da reação e do gráfico, pode-se concluir que o valor da constante de equilíbrio químico (Kc
) para
essa reação é
Em uma garrafa de refrigerante, ou cerveja, há pelo menos uma reação química reversível ocorrendo a todo o tempo: a decomposição do ácido carbônico em meio aquoso, como mostra a equação química abaixo:
H2CO3(aq) ⇌ H2O(l) + CO2(g) ∆H > 0
Segundo o Princípio de Le Châtelier, quando a garrafa é aberta, ocorre:
(1) CO2(g) ⇋ CO2(aq) (2) CO2(aq) + H2O (l) ⇋ H2CO3(aq) (3) H2CO3(aq) + H2O (l) ⇋ HCO3-(aq)+ H3O+ (aq)
I. O equilíbrio representado na equação 3 mostra o ácido carbônico, que é um ácido fraco, e o HCO3- sua base conjugada.
II. A adição de H3O+, proveniente de uma substância ácida, reage com os íons hidrogenocarbonato deslocando o equilíbrio (equação 3) para a esquerda.
III. A solução tampão impede a variação de pH somente quando substâncias ácidas são adicionadas, não sendo possível a manutenção do pH frente à adição de substâncias básicas.
IV. A solução tampão mantém o pH relativamente constante, independentemente da quantidade de H3O+ adicionada .
É CORRETO afirmar que
“O vinagre é uma solução diluída de ácido acético, elaborada de dois processos consecutivos: a fermentação alcoólica, representada pela conversão de açúcar em etanol por leveduras, e a fermentação acética, que corresponde à transformação do álcool em ácido acético por determinadas bactérias. [...]. O ácido acético é um ácido orgânico que pertence ao grupo dos ácidos carboxílicos e apresenta alta gama de utilizações. Uma de suas principais ações é como agente antimicrobiano. Em uma análise bacteriológica in vitro verificou-se que o ácido acético a 2,0 e 5,0% é eficaz sobre Pseudomonas aeruginosa e Escherichia coli. Posteriormente, estudos in vivo também demonstraram a atividade antibacteriana desse ácido. Diante disso, o vinagre pode ser utilizado como agente antimicrobiano devido a sua concentração de ácido acético.”
Bromatologia em Saúde, UFRJ. “Vinagre de maçã: sinônimo de saúde
e beleza”, 2011. Disponível em: http://bromatopesquisasufrj.blogspot.com.br/2011/12/vinagre-de-maca-sinonimo-de-saude-e.html. Acesso em nov. 2017. (Adaptado)
Quando aldeídos, como o formaldeído, são dissolvidos em água, há formação de hidratos (conforme representação na equação abaixo). Essa reação é catalisada tanto por ácidos quanto por bases.
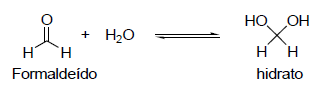
Sobre a reação, considerando temperatura constante, a adição de um(a)
NH4OH(aq)
 NH4+(aq) + OH-
(aq)
NH4+(aq) + OH-
(aq)
Adiciona-se 1 mL de solução aquosa de cloreto de amônio (NH4Cl),com concentração igual a 1 mol L-1 , a 100 mL da solução aquosa de concentração igual a 0,1 mol L -1 de hidróxido de amônio (NH4OH). Após a adição da solução salina, o pH da solução resultante, em relação ao pH da solução original de NH4OH, se torna
Considere os dados termodinâmicos da reação abaixo, na tabela a seguir.

Com base nesses dados, considere as seguintes afirmações sobre o deslocamento do equilíbrio químico dessa reação.
I - O aumento da temperatura desloca no sentido dos produtos.
II - O aumento da pressão desloca no sentido dos produtos.
III- A adição de CO2 desloca no sentido dos reagentes.
Quais estão corretas?
O “galinho do tempo” é um objeto típico de Portugal muito vendido como lembrança desse país. Esse souvenir muda de cor reversivelmente entre rosa e azul, de acordo com a variação climática do local (temperatura e umidade do ar), devido à presença do composto químico cloreto de cobalto nesse objeto. A reação química que ocorre é demonstrada pela equação química abaixo:

Considerando o equilíbrio químico envolvido na reação química que ocorre no “galinho do tempo”, analise as proposições.
I. Quando a temperatura do local onde o “galinho do tempo” se encontra for elevada, a coloração dele será azul.
II. O “galinho do tempo” apresentará coloração rosa quando a umidade do ar for elevada.
III. Em dias frios e chuvosos, a coloração do “galinho do tempo” será rosa.
Assinale a alternativa correta.
Na situação de equilíbrio para a reação
2S02(g) + O2(g) ⇄ 2SO3(g)
as concentrações de reagentes e produtos a 1000 K foram determinadas como sendo [SO2] = 0.27 m ol.L-1, [O2] = 0.40 mol.L-1 e [SO3] = 0.33 m ol.L-1.
Na temperatura dada, o valor da constante de equilíbrio da
reação em termos de concentração será:
I. Ocorrerá aumento do pH dessa solução. II. Ocorrerá diminuição do pH dessa solução. III. Não ocorrerá alteração do pH. IV. Ocorrerá precipitação de Ca(OH)2.
Marque a alternativa que indica a(s) afirmação(ões) correta(s):
2H2(g) + O2(g)→ 2H2O(v)
Uma das reações utilizadas para a demonstração de deslocamento de equilíbrio, devido à mudança de cor, é a representada pela equação a seguir:
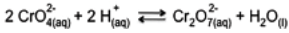
sendo que, o cromato (CrO42- ) possui cor amarela e o dicromato (Cr2O72- ) possui cor alaranjada.
• Sobre esse equilíbrio foram feitas as seguintes afirmações:
I. A adição de HCl provoca o deslocamento do equilíbrio para a direita.
II. A adição de NaOH resulta na cor alaranjada da solução.
III. A adição de HCl provoca o efeito do íon comum.
IV. A adição de dicromato de potássio não desloca o equilíbrio.
• As afirmações corretas são:
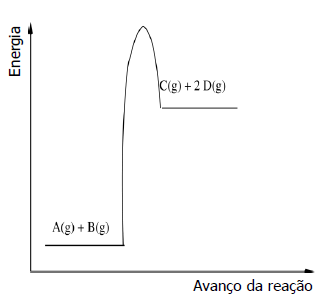
Considere as seguintes afirmações a respeito dessa reação.
I - A posição de equilíbrio é deslocada a favor dos produtos, sob aumento de temperatura.
II - A posição de equilíbrio é deslocada a favor dos reagentes, sob aumento de pressão.
III- A velocidade da reação inversa aumenta com a temperatura.
Quais estão corretas?
