Questões de Vestibular
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 233 questões
1 N2(g) + 3 H2(g) ⇌ 2 NH3(g) ∆H = –17 kcal/mol
A respeito desse equilíbrio, assinale a afirmativa incorreta.
Um dado sistema em que inicialmente existem apenas reagentes pode convergir para um estado em que há reagentes e produtos coexistindo com concentrações constantes ao longo do tempo. Essas concentrações não se alteram em razão de as reações direta e inversa se processarem com velocidades iguais, o que caracteriza um estado de equilíbrio dinâmico.
De acordo com essas informações e considerando o sistema, representado pela equação química, formado inicialmente pela mistura de 1,0mol de Br2(g) com 1,0mol de H2(g), contida em um recipiente de 10,0L, a determinada temperatura, ao atingir o estado de equilíbrio, apresentou 0,20mol de HBr, é correto afirmar:
De acordo com o princípio de Le Chatelier, se um sistema em equilíbrio é perturbado por uma variação de temperatura, pressão ou concentração de seus componentes, o sistema deslocará sua posição de equilíbrio de tal forma que neutralize o efeito do distúrbio. A partir da aplicação do princípio de Le Chatelier ao sistema em equilíbrio químico, representado pela equação termoquímica, é correto afirmar:
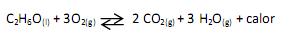
A partir desta reação, é correto afirmar que:
Durante a Primeira Guerra Mundial, um bloqueio naval britânico impediu, estrategicamente, a remessa de salitre-do-chile para a Alemanha. Esse material, vindo de uma região desértica do norte do Chile, era partida para produção de explosivos, pois contém nitrato de sódio (NaNO3) , e era também responsável por dois terços da fabricação de fertilizantes no mundo, o que poderia prejudicar a produção de alimentos à época. A solução para tais problemas foi encontrada pelos trabalhos dos químicos alemães Fritz Haber e Carl Bosch, através de um processo onde são usados o nitrogênio atmosférico e o gás hidrogênio para produzir amoníaco (NH3), de forma economicamente viável, para a substituição do salitre. A equação química que representa esse processo é:
N2(g) + 3H2(g) ⇌ 2 NH3(g); ΔH < 0
Contudo, considerando em um determinado instante que o sistema esteja em equilíbrio, a produção de amoníaco será aumentada se:
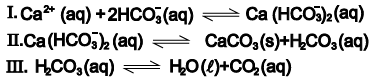
As algas zooxanthellae são também responsáveis pela intensa precipitação de carbonatos no esqueleto dos corais escleractíneos principais formadores dos recifes. Em pH próximo a 8,5, a maior parte do CO2 (aq) disponível na água do mar se encontra na forma de íons bicarbonato, HCO3- (aq). Devido à intensa radiação solar, os corais e os invertebrados que possuem algas simbiontes — sensíveis a pequenas alterações de temperatura — capturam ativamente íons de cálcio, Ca2+(aq), que reagem com íons bicarbonato.O bicarbonato de cálcio se decompõe em carbonato de cálcio, que se precipita sob forma de esqueleto, e ácido carbônico, H2CO3 (aq), usado na fotossíntese. Trata-se de um processo bioquímico muito eficiente, porém sujeito às alterações das concentrações de CO2 (g), na atmosfera.
Uma análise do processo bioquímico de formação de esqueleto de carbonato de cálcio dos corais escleractíneos referidos no texto e de acordo com as equações químicas I, II e III, permite afirmar:
No equilíbrio, a produção de SO3 pode variar em função das condições operacionais. Duas destas condições estão representadas nas figuras 2 e 3.
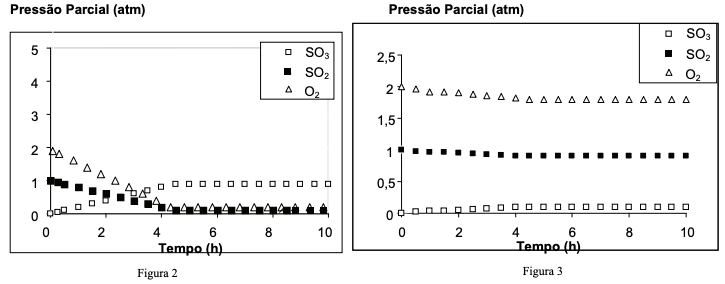
A partir destas informações, indique com V as alternativas verdadeiras e com F as alternativas falsas.
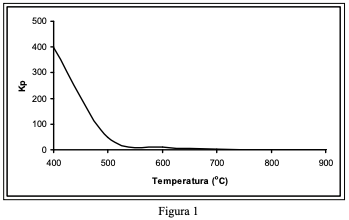
( ) A figura 2 corresponde a um processo ocorrido a temperatura de 400oC, com um valor da constante de equilíbrio, Kp, elevado. ( ) A figura 3 corresponde a um processo ocorrido a temperatura de 700oC com um valor da constante de equilíbrio, Kp, elevado. ( ) A figura 2 corresponde a um processo ocorrido a temperatura de 400oC com um valor da constante de equilíbrio, Kp, baixo. ( ) A figura 3 corresponde a um processo ocorrido a temperatura de 700oC com um valor da constante de equilíbrio, Kp, baixo.
Assinale a alternativa que indique a seqüência exata:
SO2(g) + ½ O2(g)
 SO3(g) + calor
SO3(g) + calor
Nas Figuras a seguir são apresentadas a influência da temperatura em função do tempo de conversão para atingir o equilíbrio (Figura 1) e a influência da temperatura sobre a percentagem de conversão de SO2 em SO3 no equilíbrio (Figura 2).
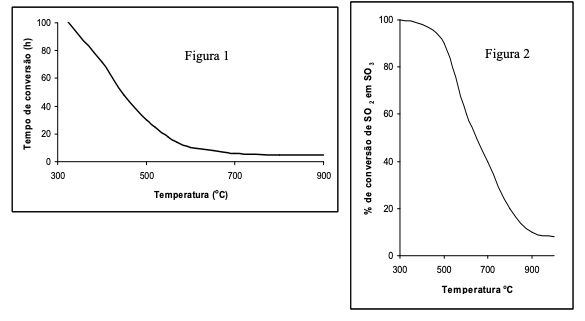
Analisando os gráficos, assinale a alternativa que representa a melhor condição de processo para aumentar a velocidade e o rendimento de SO3 .
CO2(g) ↔ CO2(aq) ΔH = –14,8 kJ/mol
Suponha que a geração de espuma esteja relacionada à quantidade de gás liberado durante a abertura da garrafa e que duas garrafas sejam abertas no mesmo bar, uma a 6 oC e outra a 25 oC.
Em relação à acidez da cerveja, pode-se concluir que:
Considere a informação acima e o equilíbrio a seguir:
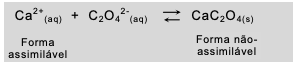
Esse equilíbrio está relacionado com as formas do cálcio assimilável pelo intestino humano e com as do não-assimilável. Uma quantidade elevada de alimentos ricos em oxalato dificulta a absorção de Ca2+ porque
Considere a tirinha a seguir.

FELTRE, Ricardo. Fundamentos da Química, volume único. São Paulo: Moderna, 1996. p.351. [Adaptado]
Aplicada ao equilíbrio químico, a idéia que o personagem tem sobre equilíbrio
Fritz Haber, prêmio Nobel de química em 1918, ficou famoso por causa da síntese da amônia a partir do nitrogênio atmosférico, alguns meses antes da Primeira Guerra Mundial (1914-1918). A produção inicial, entre três e cinco toneladas de nitrato, aumentou rapidamente com as contribuições de Carl Bosch: em 1918 ultrapassava 300.000 toneladas anuais. O processo Haber-Bosch é uma reação entre o nitrogênio e o hidrogênio para produzir amoníaco. Esta reação é catalisada com ferro, sob as condições de 200 atmosferas de pressão e uma temperatura de 450°C.
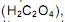 como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.
como acelga, soja e cacau, dificultam a absorção dos íons Ca 2+ pelo intestino.Considere a informação acima e o equilíbrio a seguir:

Esse equilíbrio está relacionado com as formas do cálcio assimilável pelo intestino humano e com as do não-assimilável.
Uma quantidade elevada de al imentos ricos em oxalato dificulta a absorção de Ca 2+ porque
Considere a tirinha a seguir.

Apl icada ao equi líbrio químico, a idéia que o personagem tem sobre equi líbrio

A diminuição da concentração de oxigênio nas redondezas da célula:

Nesse caso, a substância responsável por essa mudança de coloração é o cloreto de cobalto,
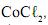 que, de acordo com a situação, apresenta duas cores distintas — azul ou rosa —, como representado nesta equação:
que, de acordo com a situação, apresenta duas cores distintas — azul ou rosa —, como representado nesta equação: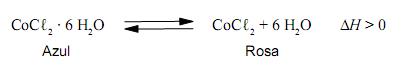
Considerando-se essas informações, é CORREtO afrmar que as duas condições que favorecem a ocorrência, no “galinho do tempo”, da cor azul são
