Questões de Vestibular
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 233 questões

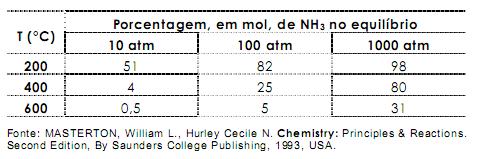
As condições econômicas aceitáveis, para se produzir amônia industrialmente, são: pressão acima de 100 atm, temperatura em torno de 450°C e u so de um catalisador.
Com base em todas essas informações, pode-se afirmar:

O gráfico abaixo representa a modificação que acontece nas concentrações dos reagentes e produto, após uma perturbação do equilíbrio no tempo t1
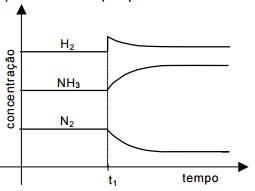
De acordo com o gráfico, essa perturbação poderia ser causada por


Considerando essas informações, julgue os itens seguintes.
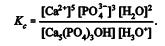

Considerando essas informações, julgue os itens seguintes.
Dentre os equilíbrios químicos,
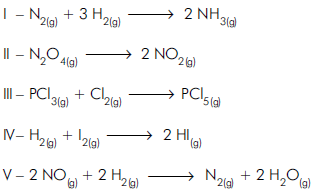
aquele com Kp = Kc é o
(F): 6H2O + 6CO2 ⇌ C6H12O6 + 6O2
(R): C6H12O6 + 6O2 ⇌ 6H2O + 6CO2
Sabendo-se que a fotossíntese só ocorre em presença de luz, pode-se afirmar que a concentração de
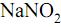 é um dos aditivos mais utilizados na conservação de alimentos. É um excelente agente antimicrobiano e está presente em quase todos os alimentos industrializados à base de carne, tais como presuntos, mortadelas, salames, entre outros. Alguns estudos indicam que a ingestão deste aditivo pode proporcionar a formação no estômago de ácido nitroso e este desencadear a formação de metabólitos carcinogênicos.
é um dos aditivos mais utilizados na conservação de alimentos. É um excelente agente antimicrobiano e está presente em quase todos os alimentos industrializados à base de carne, tais como presuntos, mortadelas, salames, entre outros. Alguns estudos indicam que a ingestão deste aditivo pode proporcionar a formação no estômago de ácido nitroso e este desencadear a formação de metabólitos carcinogênicos.Dada a constante de hidrólise:
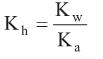
e considerando as constantes de equilíbrio
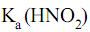 = 5 × 10–4 e
= 5 × 10–4 e 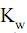 = 1 × 10–14, a 25 oC, o pH de uma solução aquosa de nitrito de sódio 5 × 10–2 mol/L nesta mesma temperatura tem valor aproximadamente igual a
= 1 × 10–14, a 25 oC, o pH de uma solução aquosa de nitrito de sódio 5 × 10–2 mol/L nesta mesma temperatura tem valor aproximadamente igual a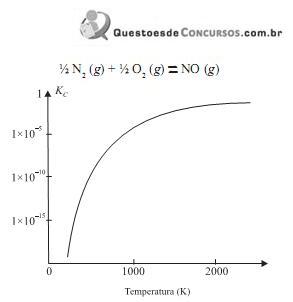
Considere as seguintes afirmações:
I. Um catalisador adequado deslocará o equilíbrio da reação no sentido da conversão do NO em
II. O aumento da pressão favorece a formação do NO.
III. A 2400 K há maior quantidade de NO do que a 1200 K. IV. A reação de formação do NO é endotérmica.
São corretas as afirmações contidas somente em
Sabe-se que, no equilíbrio, a velocidade de formação dos produtos, V, e a velocidade inversa, de formação dos reagentes, V’ , são iguais:
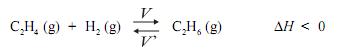
Foram realizados dois experimentos envolvendo essa reação, com apenas uma diferença: um, na presença de catalisador; o outro, na ausência deste.
Comparando-se esses dois experimentos, é CORRETO afirmar que, na reação catalisada, aumenta
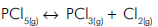
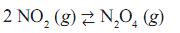
Quando esse recipiente é colocado em um banho de água e gelo, o gás torna- se incolor. Em relação a esse sistema, são feitas as seguintes afirmações:
I. A reação no sentido da formação do gás incolor é exotérmica.
II. Com o aumento da pressão do sistema, a cor castanha é atenuada.
III. Quando o sistema absorve calor, a cor castanha é acentuada.
Dentre as afirmações, as corretas são: