Questões de Vestibular
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 233 questões
De acordo com a figura e as informações do texto,infere-se que:

O lança-perfume é uma droga inalante consumida principalmente no Carnaval. É constituído por solventes voláteis que, quando inalados, são levados, via corrente sanguínea, para todo o organismo. Por induzir a produção de adrenalina no organismo, a droga acelera a frequência cardíaca, proporcionando sensação de euforia e desinibição, ao mesmo tempo em que confere
perturbações auditivas e visuais, perda de autocontrole e visão confusa. O cloreto de etila
 e o éter dietílico
e o éter dietílico  , componentes principais do lança-perfume, podem ser sintetizados a partir do
, componentes principais do lança-perfume, podem ser sintetizados a partir do  , de acordo com as
, de acordo com asreações a seguir.

Considerando as reações acima e os valores de entalpias padrão de
formação —
 — a 25 ºC, apresentados na tabela, julgue os itens seguintes.
— a 25 ºC, apresentados na tabela, julgue os itens seguintes. 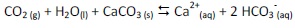
De acordo com essa equação química, dadas as afirmativas seguintes,
I. A reação química é reversível.
II. As espécies químicas presentes no lado dos produtos são chamadas de íons.
III. A equação química não está corretamente balanceada.
IV. A reação química para estar em equilíbrio, a velocidade da reação direta tem que ser igual à velocidade da reação inversa.
verifica-se que estão corretas
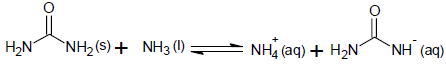
Sobre a natureza das interações entre as espécies envolvidas na reação, o comportamento químico das substâncias reagentes e o átomo de nitrogênio, é correto afirmar:
 Cd + 2 OH− Eº= − 0,81V
Cd + 2 OH− Eº= − 0,81V Ni(OH)2 + OH− Eº= + 0,49 V
Ni(OH)2 + OH− Eº= + 0,49 V 
Cada tipo de planta cresce melhor em solos com faixa específica de pH. Os valores de pH do solo se devem à solução intersticial presente, ou seja, a água presente no solo e seus respectivos solutos. A tabela abaixo fornece a faixa de “pH ótimo” para algumas plantas, o que facilita a produtividade de flores e frutos.
CaO(s) + H2O(l)
 Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq) + 2 OH-
(aq)
Ca2+(aq) + 2 OH-
(aq) DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
2 NO(g) + O2(g)⇽⇾ 2 NO2(g) ΔH <0
Considerando o sistema acima em equilíbrio, é correto afirmar-se que a produção de dióxido de nitrogênio será favorecida quando se
Um sistema químico em equilíbrio, a uma dada temperatura, contém os gases N2, H2 e NH3, como mostra a equação a seguir.
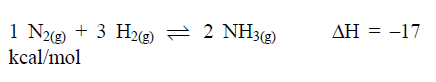
A respeito desse equilíbrio, assinale a afirmativa
incorreta.
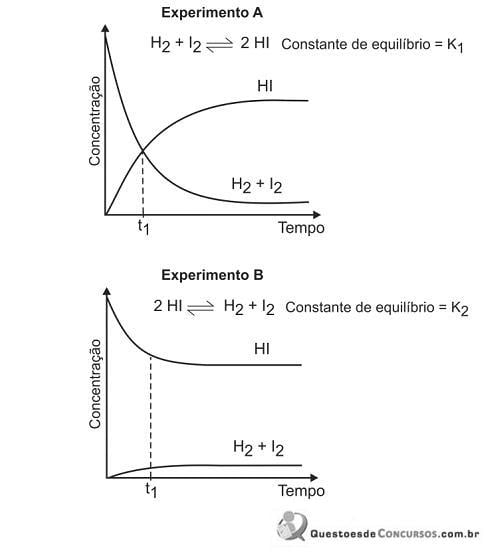
Pela análise dos dois gráficos, pode-se concluir que

A análise do gráfico permite concluir, corretamente, que:
4 NH3(g) + 5 O2(g) 4 NO(g) + 6 H2O(g) ΔH = -900KJ
Sobre a reação, é correto afirmar que:

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.
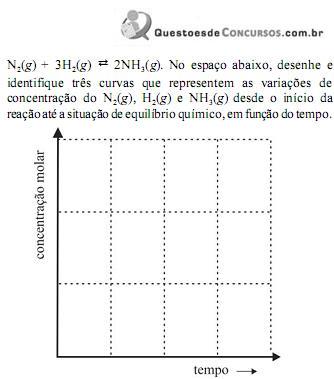
O espaço reservado acima é de uso opcional, para rascunho. Caso o utilize, não se esqueça de transcrever o seu esboço para o Caderno de Respostas.

Considerando as informações acima, julgue os itens 50 e 51, assinale a opção correta no item 52, que é do tipo C, e faça o que se pede no item 53, que é do tipo D.
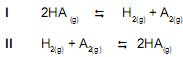
O valor da constante de equilíbrio (KI ) para a reação (I) é 4,17 x 10-34 a 25o C. Assim sendo, pode-se afirmar que o valor da constante de equilíbrio (KII ) para a reação (II) na mesma temperatura será
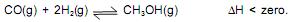
A produção industrial de metanol envolve a reação do monóxido de carbono com o hidrogênio, em determinadas condições, de acordo com o sistema em equilíbrio representado pela equação química.
Considerando-se essas informações e a equação química que representa o sistema em equilíbrio, é correto afirmar:
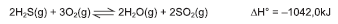
O deslocamento do equilíbrio químico de um sistema é toda e qualquer alteração de velocidade de reação direta ou inversa, que provoca modificações nas concentrações de substâncias químicas e, consequentemente, leva a um novo estado de equilíbrio.
A aplicação desse conceito de deslocamento de equilíbrio químico ao sistema representado pela equação química permite corretamente afirmar:

