Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 330 questões
Considere que, em solução aquosa, o H3AsO4 sofra três reações de dissociação ácida, cujas equações químicas estão expressas a seguir.
H3AsO4 (aq) ⇌ H+ (aq) + H2AsO4 − (aq)
H2AsO4 − (aq) ⇌ H+ (aq) + HAsO4 2− (aq)
HAsO4 2− (aq) ⇌ H+ (aq) + AsO4 3− (aq)
Nessa situação, a base conjugada da espécie H2AsO4 − é o íon HAsO4 2−.
Se a concentração de uma solução de NaOH for de 0,10 mol/L, então o pH dessa solução será superior a 10.
Considere-se que o SO2 atmosférico sofra hidrólise nas gotículas de água da atmosfera em uma série de reações reversíveis, conforme descrito a seguir.
SO2 (g) + H2O (l) ⇌ H2SO3 (aq)
H2SO3 (aq) ⇌ H+ (aq) + HSO3 − (aq)
HSO3 − (aq) ⇌ H+ (aq) + SO3 2− (aq)
Nessa situação, caso a concentração atmosférica de SO2 aumente, a concentração de íons SO3 2− dissolvidos na água da chuva aumentará.
No meio atmosférico, ocorrem numerosas reações que reduzem o enxofre do estado de oxidação +6 para o estado de oxidação +4, o que leva à formação de ácido sulfúrico (H2SO4), um dos ácidos mais fortes conhecidos.
1) Dissolveu-se uma pastilha de permanganato de potássio (KMnO4) em um becker contendo 40mL de água destilada, com formação da cor violeta. 2) A seguir, adicionou-se neste becker, 20mL de vinagre incolor, permanecendo a cor violeta. 3) Neste mesmo becker, adicionou-se 20mL de água oxigenada, H2O2 (10 vol.), e imediatamente a cor violeta desapareceu, ficando incolor. 4) Em outro becker, repetiu-se a etapa 1 desse procedimento, e logo a seguir adicionou-se 20mL de água oxigenada (10 vol.), ocorrendo a mudança da cor violeta para marrom.
Com relação a essa experiência, assinale a alternativa correta.
Com base no texto anterior e nas informações precedentes e considerando que 1 L = 1 dm3 , julgue o item.
A primeira constante de dissociação ácida do ácido cítrico
(Ka1) é superior a 10−3.
HbH+ (aq) + O2(g) ⇌ HbO2(aq) + H+ (aq)
O dióxido de carbono liberado na respiração pode alterar esse equilíbrio devido à formação de ácido carbônico, representado pela equação:
CO2(g) + H2O(l) ⇌ H+ (aq) + HCO3 − (aq)
Com base nessas informações, é correto afirmar:
Considerando as informações do texto apresentado, julgue o item a seguir.
Considere que, no tratamento da água com hipoclorito de sódio, ocorra a seguinte reação, que tem constante de equilíbrio Kb = 1,0 × 10−7.
ClO− (aq) + H2O(l) ⇌ HClO(aq) + OH− (aq)
Nessa situação, em uma solução aquosa em que essa reação ocorre a pH = 6, a quantidade de mols de HClO é igual à quantidade de mols de ClO− no equilíbrio.
DADOS QUE PODEM SER USADOS NESTA PROVA

O pH de uma solução que contém um precipitado de Cr(OH)3 (Kps = 6.0 x 10-11 a uma dada temperatura) deve ser ajustado de modo que todo o precipitado se dissolva, produzindo uma solução na qual a [Cr3+] seja 0.1 mol/L.
Nesse caso, o valor do pH é de, aproximadamente:
Dado: Kw = 1.0x 10-14
O hidróxido de alumínio (Al(OH)3), ao precipitar em solução aquosa, forma um sólido gelatinoso que pode ser usado como agente floculante no tratamento de água. Essa precipitação pode ocorrer pela adição de um hidróxido solúvel a uma solução aquosa ácida contendo um sal de alumínio solúvel, como o AlCl3. Entretanto, adicionando-se excesso de hidróxido ao meio, há a formação de íons Al(OH)4− , espécie solúvel em água, e o precipitado se solubiliza novamente. Dessa forma, dependendo do pH do meio, uma dentre as espécies Al(OH)4 −(aq), Al(OH)3(s) e Al 3+(aq) estará presente na solução em quantidade maior que as demais, como exemplificado no esquema.
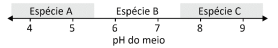
A alternativa que mostra corretamente qual das espécies estará
em quantidade maior que as duas outras em cada faixa de pH é:
DADOS QUE PODEM SER USADOS NESTA PROVA

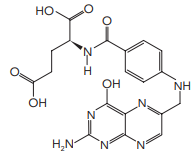
Considere um dado valor de pH, para o qual apenas os hidrogênios das carboxilas do ácido fólico se ionizam. Nessa situação, a carga do ânion formado é igual a:
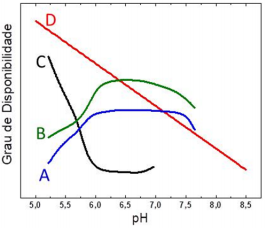
Considerando essas informações e os conhecimentos de química, é correto afirmar que a calagem atua em solos

Um aluno do curso de química em uma aula prática de Química Geral, precisa preparar uma solução de hidróxido de potássio de pH = 12 a 25ºC. qual a massa de KOH que ele precisa dissolver em 200 mL de água para obter o pH desejado?
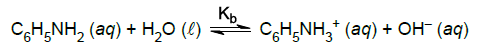
Sabe-se que Kb ≈ 4 × 10–10 a 25 ºC e que o valor de pH de uma solução aquosa saturada de anilina a 25 ºC é próximo de 9. Com base nessas informações e sabendo que Kw nessa temperatura é igual a 1 × 10–14, a concentração aproximada da solução saturada de anilina a 25 ºC é
Uma amostra de água mineral natural a 25 °C foi testada com três indicadores ácido-base. Os resultados desse teste estão indicados na última coluna da tabela.

Analisando as informações da tabela e sabendo que o
produto iônico da água a 25 °C, Kw, é igual a 1 × 10−14, a
concentração de íons OH− (aq) nessa água mineral, em
mol/L, está entre