Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 328 questões
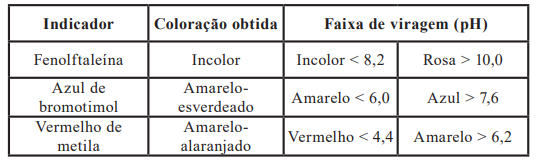
De acordo com o resultado obtido experimentalmente, pode-se seguramente afirmar que a faixa de pOH da amostra desconhecida, de acordo com a coloração obtida, encontra-se entre
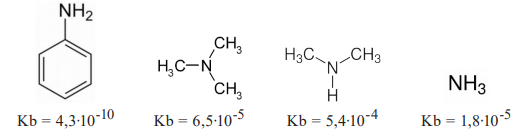

A ordem crescente de basicidade, das substâncias químicas acima citadas, é
Considera-se que quando uma pessoa ingere dois copos de água, seu suco gástrico (solução de ácido clorídrico, pH igual a 1) dilui de 50 para 500 mL. Nessa condição o pH da solução restante logo após a ingestão da água será de:
I. Ocorrerá aumento do pH dessa solução. II. Ocorrerá diminuição do pH dessa solução. III. Não ocorrerá alteração do pH. IV. Ocorrerá precipitação de Ca(OH)2.
Marque a alternativa que indica a(s) afirmação(ões) correta(s):
I - É uma solução de pH menor que 7. II - É mais alcalina do que uma solução aquosa de NaCI. III- É mais ácida do que uma solução aquosa de NaOH de mesma concentração.
Quais estão corretas?
Dado: MM (KOH) = 56 g.mol-1
De acordo com as informações apresentadas, verifica-se que essa solução apresenta
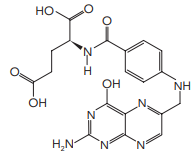
Considere um dado valor de pH, para o qual apenas os hidrogênios das carboxilas do ácido fólico se ionizam. Nessa situação, a carga do ânion formado é igual a:
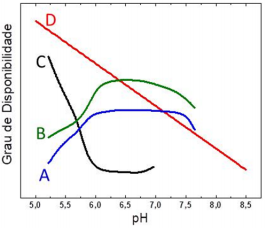
Considerando essas informações e os conhecimentos de química, é correto afirmar que a calagem atua em solos
Considere que uma colher de sopa de vinagre com um teor de ácido acético de 3,0 % (m/v) foi misturada com 4 colheres de sopa de água para ser usada em limpeza. O valor de pH do vinagre após a diluição é de:
Um aluno do curso de química em uma aula prática de Química Geral, precisa preparar uma solução de hidróxido de potássio de pH = 12 a 25ºC. qual a massa de KOH que ele precisa dissolver em 200 mL de água para obter o pH desejado?
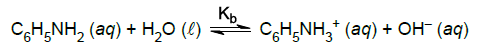
Sabe-se que Kb ≈ 4 × 10–10 a 25 ºC e que o valor de pH de uma solução aquosa saturada de anilina a 25 ºC é próximo de 9. Com base nessas informações e sabendo que Kw nessa temperatura é igual a 1 × 10–14, a concentração aproximada da solução saturada de anilina a 25 ºC é
Uma amostra de água mineral natural a 25 °C foi testada com três indicadores ácido-base. Os resultados desse teste estão indicados na última coluna da tabela.

Analisando as informações da tabela e sabendo que o
produto iônico da água a 25 °C, Kw, é igual a 1 × 10−14, a
concentração de íons OH− (aq) nessa água mineral, em
mol/L, está entre
Sob temperatura de 25ºC temos soluções aquosas equimolares (mesma quantidade de matéria) de dois ácidos. Dado: Ki = constante de ionização.
H2CO3: Ki1 = 4,6.10-7 e Ki2 = 4,4.10-11
H2S2O3: Ki1 = 3,0.10-1 e Ki2 = 2,5.10-2
Assinale a alternativa que contém a ordem crescente de abundância dos ânions correspondente aos ácidos citados acima.
BICARBONATO DE SÓDIO PARA
COMBATER RESFRIADOS E GRIPES
Pode ajudar a manter um correto equilíbrio no pH do sangue, o que ajuda a combater e evitar as gripes e resfriados. Em 1924, o Dr. Volney S. Cheney, um médico que trabalhou para o serviço de saúde pública nos Estados Unidos, publicou o artigo “Arm & Hammer Baking Soda Medical Use” no qual relatou os resultados de alguns testes usando o bicarbonato de sódio, e o resultado foi que quem fez o tratamento com esse mágico mineral não contraiu nenhum resfriado ou gripe. O tratamento para resfriados, usando bicarbonato de sódio, é muito fácil de fazer, junte 1/2 colher de chá (0,03 mol) de bicarbonato de sódio em um copo de água fria (100 mL) e beba em seguida. Deve-se beber um copo de manhã e outro à noite até os sintomas do resfriado desaparecerem por completo.
Disponível em: http://www.remedios-caseiros.com/remedios/bicarbonatode-sodio.html. Adaptada. Acesso em: 11 de agosto de 2015.
[Dados: Kw = 1 · 10–14; Ka(H2CO3) = 4,3 · 10–7; √69 ≅ 8,3; 3/4,3 ≅ 0,69; log 8,3 ≅ 0,92]
De acordo com o texto, é pertinente inferir que o pH da solução de bicarbonato de sódio é, aproximadamente,

A esses frascos foi adicionado extrato de repolho roxo, um indicador ácido-base. Em meio muito ácido, esse extrato adquire coloração vermelha; em meio moderadamente ácido, rosa; e em meio básico, verde.
As colorações dos líquidos contidos nesses frascos, respectivamente, após a adição do extrato são:
Observe a escala abaixo:

O suco extraído do repolho roxo pode ser utilizado como indicador do caráter ácido (pH entre 0 e 7) ou básico (pH entre 7 e 14) de diferentes soluções. Misturando-se um pouco de suco de repolho e da solução, a mistura passa a apresentar diferentes cores, segundo sua natureza ácida ou básica, de acordo com a escala acima, que relaciona a cor final do sistema substância + indicador com o pH aproximado que ela possui. Ao testar algumas soluções com o suco de repolho roxo, foram obtidos os seguintes resultados:
- Amoníaco: verde
- Leite de magnésia: azul
- Vinagre: vermelho
- Leite de vaca: rosa
Com base nessas informações, as substâncias amoníaco, leite de magnésia, vinagre e
leite de vaca têm caráter respectivamente:
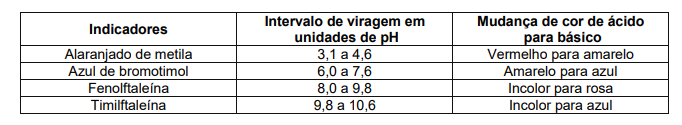
Para diferenciar-se uma solução de pH=5,0 de uma solução de pH=8,0, ambas incolores, deve-se usar o indicador
