Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 328 questões
CO2(aq) + H2O(l) ⇌ H2CO3(aq) ⇌ H 1+ (aq) + HCO3- (aq)
Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o HCO3- (aq) e o H2CO3(aq) é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao organismo, devido às alterações metabólicas, podendo causar a morte.
Levando em conta as informações acima, é correto afirmar que
Tendo por base esta informação, assinale a afirmação verdadeira.
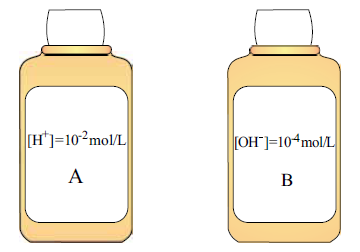
A razão entre os valores de pH da solução B e da solução A, a 25 o C, é
É correto afirmar que a diferença de unidades de valores de pH dessas soluções é igual a
Considerando log2 = 0,3, ao adicionar água destilada a 10 mL de suco de abacaxi concentrado, até atingir o volume de 500 mL, o pH dessa solução será igual a

Completam as lacunas do texto, respectivamente,
Em relação às reações inorgânicas em solução, é INCORRETO afirmar que:
A tabela mostra valores do pH da água líquida em diferentes temperaturas.
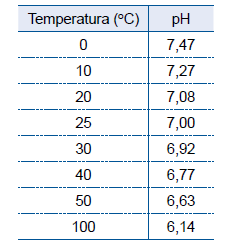
A análise desses dados permite afirmar que o produto iônico da água, Kw,_______ com a elevação da temperatura e que a reação de autoionização da água _______ energia, sendo, portanto, um processo _______.
As lacunas do texto devem ser preenchidas por:
 H+(aq) + CN-
(aq)
H+(aq) + CN-
(aq)
 H+(aq) + CN-
(aq)
H+(aq) + CN-
(aq)
NaCℓO → Na+ + CℓO–
CℓO– + H2O
O número de oxidação do cloro no íon hipoclorito e a condição ideal para aumentar a concentração desse íon na solução são
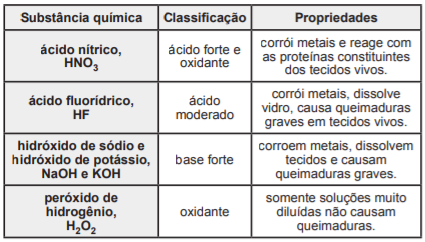
As substâncias químicas corrosivas – como os ácidos e as bases fortes, os agentes oxidantes e os desidratantes –, a exemplo das mencionadas na tabela, devem ser utilizadas com cautela, porque o contato com elas, além da corrosão de materiais metálicos, causa a deterioração de tecidos presentes nos seres vivos.
MANAHAN, Stanley E. Química ambiental, e. 9. Porto Alegre: Bookman, 2013, p. 681. Adaptado.
Considerando-se essas informações e as propriedades das substâncias químicas, é correto afirmar:
Em razão dos intensos exercícios físicos, os praticantes de esportes de alta performance podem sofrer de “acidose”, cujos sintomas iniciais podem ser: cefaleia (dor de cabeça), sonolência, tremor nos músculos etc. Ao praticar esporte, o organismo libera grandes quantidades de ácido láctico na corrente sanguínea, e o sangue então se torna ácido (pH < 7). Para evitar os efeitos colaterais da acidose, o organismo deve liberar no sangue uma quantidade de base bicarbonato, suficiente para neutralizar esta acidez através do efeito tampão.
Sabendo que o equilíbrio de transferência de prótons do ácido carbônico é:
H2CO3(aq) + H2O(l) HCO3 −
(aq) + H3O
+
(aq)
HCO3 −
(aq) + H3O
+
(aq)
Ka = [HCO3] / [H2CO3] . [H3O+]
e que o pKa do ácido carbônico nas condições
fisiológicas do corpo é 6,1, qual deve ser a proporção
entre as concentrações do íon bicarbonato e do ácido
carbônico [HCO3−]/[H2CO3], para que o pH do sangue
seja mantido em 7,34 (o pH ideal do sangue)?
Dados: log 1,2.10-2 = -1,92.
HCO3 – (aq) + H2O(l)
 CO3
2–(aq) + H3O
+
(aq)
CO3
2–(aq) + H3O
+
(aq) A respeito de uma solução em que as concentrações de carbonato (CO3 2–) e bicarbonato (HCO3 – ) são iguais, podemos dizer que:
NaHCO3(aq) + HCl(aq) → NaCl(aq) + H2CO3(aq) H2CO3(aq)
 H2O(l) + CO2(g)
H2O(l) + CO2(g)
Com relação às reações acima, três afirmações foram feitas:
1) O NaHCO3 é uma base que reage com HCl para gerar um novo ácido, o ácido carbônico.
2) O aumento da quantidade de H2CO3 no estômago desloca o equilíbrio para a formação de CO2, que explica o alívio e liberação de gás do estômago.
3) Quando tomamos NaHCO3 o pH do estômago aumenta.
Está(ão) correta(s) a(s) afirmativa(s):

