Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 330 questões
Deixou-se o NO(g) borbulhar até que fossem acrescidos ao tubo 4 mL desse gás. Após cessar o fluxo de NO(g), o tubo foi mantido imerso na posição vertical, de modo que seu volume pudesse variar, mantendo a pressão em seu interior igual à pressão exterior, mas sem escape de gás. Após certo tempo, o gás dentro do tubo adquire cor castanha, em função da seguinte reação: 2NO(g) + O2(g)
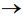 2NO2 (g)
2NO2 (g)
A respeito desse experimento, identifique as afirmativas abaixo como verdadeiras (V) ou falsas (F):
( ) O NO(g) é reagente limitante da reação. ( ) Em relação à condição imediata depois de cessado o fluxo, o volume de gás dentro do tubo irá diminuir após o gás ficar castanho. ( ) Em relação à condição imediata depois de cessado o fluxo, a pressão parcial de N2(g) dentro do tubo irá aumentar após o gás ficar castanho. ( ) O valor de pH da água na região A (dentro do tubo) irá diminuir após o gás se tornar castanho.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
INSTRUÇÃO: Para responder à questão, analise o texto e a estrutura a seguir.
Uma das preocupações do Comitê Olímpico Internacional é combater o doping de atletas nas Olimpíadas. Para isso, uma série de análises é realizada rotineiramente com amostras de urina colhidas dos atletas. Nessas análises, uma das substâncias pesquisadas é o THG, que é um esteroide anabolizante. Os métodos de análise são extremamente sensíveis, sendo possível detectar THG em uma concentração tão baixa como 1 ppb (uma parte por bilhão). Isso significa uma concentração em que há um bilionésimo de grama de THG para cada grama de amostra.
De acordo com as informações acima, assinale a
alternativa correta.
TEXTO 4
Não desejei a morte de minha filha. Ou desejei? Aí é que reside a dúvida, é onde habita o nó que nada nem ninguém no mundo tem o poder de desatar. O inconsciente, desculpe-me a vulgaridade do termo, minha filha, é uma merda. Sendo autônomo, o inconsciente age por si, sem pedir licença nem se revelar. Desejei ou não a morte de minha filha, hein? Você pode responder a essa pergunta? Alguém pode? Eu não posso. Busquei na fonte a resposta e ela não veio. Como minha filha havia feito, busquei nas águas do Cristal a cura imediata para uma dor que parecia infinda. A ferida tinha sido cavada pelas águas, então elas que tratassem de cicatrizá-la. O rio recusou meu corpo, mas não a dor. Nem o aconselhamento. Pediu tempo, apenas. Permaneci plantada no barranco, juntando ao seu caudal minhas lágrimas secas. Disseram que eu tinha enlouquecido, talvez tivesse mesmo. Em diálogo profundo, as águas me fizeram compreender verdades para as quais eu nunca havia me atinado. Todo rio tem seu leito, suas margens, seu limite, toda vez que ele avança além de seu leito original provoca estragos, descalabros. O rio de nossa vida não é diferente. Ele também está sujeito a limitações intransponíveis. Existe você e você; seu campo de visão, a capacidade de administrar o próprio caudal. Tem a hora de abrir e a hora de fechar as comportas. Felicidade ou dor, a escolha é sua, depende do grau de intensidade que você der a cada coisa. Hoje posso dizer que me conheço um pouquinho, mesmo assim, perguntas continuam sem resposta.
(BARROS, Adelice da Silveira. Mesa dos inocentes. Goiânia: Kelps, 2010. p. 23.)
O Texto 4 faz menção a rio, que, muitas vezes é o destino final dos dejetos produzidos pela nossa sociedade. São várias as substâncias que os homens despejam nos rios, causando com isso diversos problemas ambientais. Dentre essas substâncias, podemos encontrar vários compostos inorgânicos, como sais, bases e ácidos. Analise as afirmativas a seguir:
I - A hidrólise de um sal proveniente de ácido forte e uma base fraca em água resultará na redução do pH.
II - Na hidrólise de um sal proveniente de um ácido fraco e base forte, a redução do pOH está em função do deslocamento do equilíbrio (da reação de autoionização da água) para a direita.
III - A adição de NaCl à água provoca a hidrólise desta, por se tratar de um sal proveniente de uma ácido e uma base fracos.
IV - A adição NaCl à água provoca a hidrólise desta, alterando-lhe o equilíbrio iônico.
Em relação às proposições analisadas, assinale a única alternativa cujos itens estão todos corretos:
Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro (FeS2), sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo.
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:
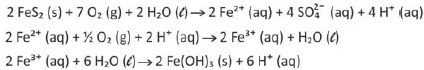
Considerando a equação química que representa a
transformação global desse processo, as lacunas da frase
“No intemperismo sofrido pela pirita, a razão entre as
quantidades de matéria do FeS2(s) e do O2(g) é __________,
e, durante o processo, o pH do solo __________” podem ser
corretamente preenchidas por
Dependendo do pH do solo, os nutrientes nele existentes podem sofrer transformações químicas que dificultam sua absorção pelas plantas. O quadro mostra algumas dessas transformações, em função do pH do solo.
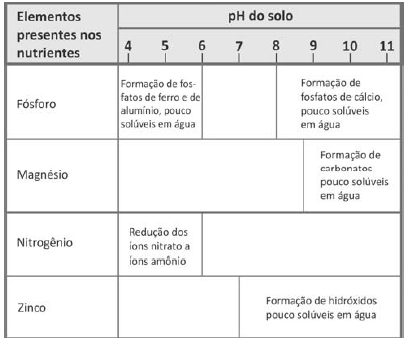
Para que o solo possa fornecer todos os elementos citados
na tabela, o seu pH deverá estar entre
Dados:
Constante de ionização (Ka) do H₂CO₃ = 4 x 10⁻⁷
Constante de ionização (Kb) do NH₃= 2 x 10⁻⁵
Constante de ionização (Kw) do H₂O = 1 x 10⁻¹⁴
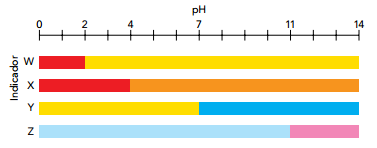
Os indicadores ácido base são substâncias cuja cor se altera em uma faixa específica de pH. Atabela a seguir apresenta afaixa de viragem (mudança de cor) de alguns indicadores ácido base.
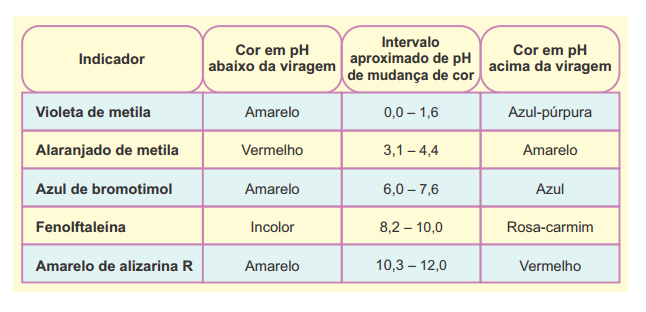
A partir da análise dessa tabela, um técnico executou um procedimento para distinguir algumas soluções.
Para diferenciar uma solução de 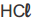 de concentração 1,0 mol.L⁻¹ de uma solução de
de concentração 1,0 mol.L⁻¹ de uma solução de 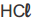 e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
A alternativa que apresenta os indicadores X, Y e Z adequados para cada um dos procedimentos propostos pelo técnico é
Com base no texto, é possível afirmar que a água do Rio Doce
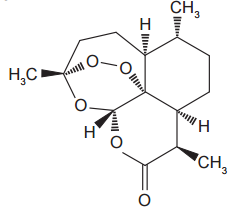
Com base nas informações, é correto afirmar que a artemisina apresenta
Em linhas gerais, o consumo de água aumentou de forma considerável em todo o planeta ao longo do tempo. Em 1900, o mundo consumia cerca de 580 km³ de água; já em 1950, esse consumo elevou-se para 1400 km³, passando para 4000 km³ em 2000. Segundo previsões da ONU, é provável que em 2025 o nível de consumo eleve-se para 5200 km³. A despeito dessa elevação da utilização da água, registra-se também o aumento do número de pessoas sem fácil acesso à água potável, totalizando 1,1 bilhão em todo o planeta a sofrer com esse problema.
Além da utilização exagerada na área doméstica e no plano individual, soma-se o intensivo consumo de água nas atividades econômicas, notadamente a agricultura e a indústria, isso sem contar o grande volume desperdiçado. Não por acaso, a maior parte do consumo mundial de água acontece nos países desenvolvidos. Os emergentes ou subdesenvolvidos consomem em menor quantidade em razão do menor acesso à água e da menor intensidade das práticas econômicas. Segundo a ONU, o consumo dos países centrais é seis vezes maior do que o consumo dos países periféricos.
Fonte: http://brasilescola.uol.com.br/geografia/consumo-agua-no-mundo.htm
O índice de acidez de um óleo é determinado com a titulação volumétrica com KOH. Uma massa de 20,00 g de óleo foi dissolvida totalmente em uma mistura de água, isopropanol e tolueno, para, em seguida, ser titulada com uma solução da base forte (0,10 mol L-1 ). O ponto de equivalência foi atingido com a adição de 2,00 mL de base.
A quantidade, em mol, de H+ reagido com a base é
Um estudante misturou 100 mL de solução de H2SO4 0,10 mol L-1 com 100 mL de solução aquosa de NaOH 0,050 mol L-1 .
Sobre a reação e seu resultado, obteve-se:
Uma solução, na qual o soluto é uma substância inorgânica, foi preparada com água pura (pH 7). Contudo, devido a um descuido, a mesma não foi rotulada. Na tentativa de identificá-la através do seu caráter ácido ou básico, mediu-se o pH, e o valor observado foi 2.
Das opções abaixo, o único soluto que poderia compor a solução é o
Considere o preparo em laboratório de duas soluções aquosas de NaOH com concentrações de 10−2 mol.L-1 e 10−6 mol.L-1 , a 25 ºC. É possível diferenciar visualmente essas soluções com a adição do seguinte indicador:
BICARBONATO DE SÓDIO PARA
COMBATER RESFRIADOS E GRIPES
Pode ajudar a manter um correto equilíbrio no pH do sangue, o que ajuda a combater e evitar as gripes e resfriados. Em 1924, o Dr. Volney S. Cheney, um médico que trabalhou para o serviço de saúde pública nos Estados Unidos, publicou o artigo “Arm & Hammer Baking Soda Medical Use” no qual relatou os resultados de alguns testes usando o bicarbonato de sódio, e o resultado foi que quem fez o tratamento com esse mágico mineral não contraiu nenhum resfriado ou gripe. O tratamento para resfriados, usando bicarbonato de sódio, é muito fácil de fazer, junte 1/2 colher de chá (0,03 mol) de bicarbonato de sódio em um copo de água fria (100 mL) e beba em seguida. Deve-se beber um copo de manhã e outro à noite até os sintomas do resfriado desaparecerem por completo.
Disponível em: http://www.remedios-caseiros.com/remedios/bicarbonatode-sodio.html. Adaptada. Acesso em: 11 de agosto de 2015.
[Dados: Kw = 1 · 10–14; Ka(H2CO3) = 4,3 · 10–7; √69 ≅ 8,3; 3/4,3 ≅ 0,69; log 8,3 ≅ 0,92]
De acordo com o texto, é pertinente inferir que o pH da solução de bicarbonato de sódio é, aproximadamente,

analise as afirmativas a seguir:
1) O ácido carbônico é um ácido forte. 2) Em pH 7,0, a razão entre as concentrações do íon bicarbonato e do ácido carbônico ([HCO3 − ]/[H2CO3]) é igual a 4,3. 3) No equilíbrio representado pela equação acima, o íon hidrogenocarbonato é uma base de BronstedLowry
Está(ão) correta(s) apenas:
I – pH = 5,4 II – pOH = 10 III – pOH = 8,5
Considerando a faixa de pH permitida, qual(is) a(s) indústria(s) que pode(m) lançar seu efluente nos corpos de água sem tratamento preliminar?
Em relação às reações inorgânicas em solução, é INCORRETO afirmar que:
HCN (aq) ⇔ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro: grau de ionização
Símbolo: α
Parâmetro: constante de equilíbrio
Símbolo: Ka
Parâmetro: potencial hidrogeniônico
Símbolo: pH
Parâmetro: concentração de HCN
Símbolo: [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
