Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 328 questões
O processo de desenvenenamento da mandioca inicia-se pela imersão da raiz da planta em um tanque com água durante a noite ou por alguns dias, até que comece uma leve fermentação ácida, o que faz baixar o valor do pH da água, criando-se um ambiente que intensifica a atividade de uma enzima já existente na planta. Com a diminuição do pH, o ácido cianídrico (HCN) permanece indissociado e é removido do líquido.
(Adaptado de J. Soentgen e K. Hilbert, A química dos povos indígenas da América do Sul, Química Nova, v. 39, n. 9, p. 1141-1150, 2016.)
O artigo explica, do ponto de vista da Química, como
ocorre o desenvenenamento da mandioca. De acordo com
o texto, esse processo é favorecido por
Dado log de 2 = 0,3

Logo no início da viagem os rapazes param para almoçar. Para temperar a salada, eles se deparam com dois tipos de vinagre: um praticamente transparente (comum, com acidez 4%) e outro bastante escuro (balsâmico, com acidez 6%).
Dados sobre a fenolftaleína: incolor, pH<8; rosa, 8<pH<10; roxa, pH>10.
Sobre o assunto, é CORRETO afirmar que:
após adição de fenolftaleína, uma solução contendo CH3COONa torna-se incolor.
Logo no início da viagem os rapazes param para almoçar. Para temperar a salada, eles se deparam com dois tipos de vinagre: um praticamente transparente (comum, com acidez 4%) e outro bastante escuro (balsâmico, com acidez 6%).
Dados sobre a fenolftaleína: incolor, pH<8; rosa, 8<pH<10; roxa, pH>10.
Sobre o assunto, é CORRETO afirmar que:
a adição de um ácido forte a uma solução de ácido etanoico desloca o equilíbrio para a
formação do ânion etanoato.
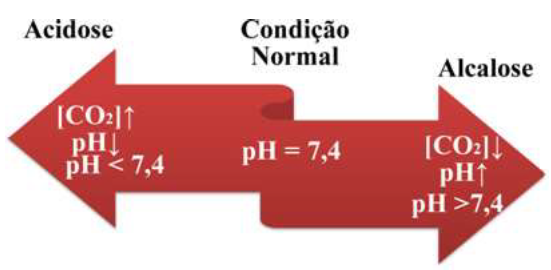
O gás carbônico, dissolvido no sangue, estabelece o seguinte equilíbrio químico:
CO2 + H2O ⇄ H2CO3 ⇄ H+ + HCO3 -
Uma pessoa fumante, com respiração deficiente em função de enfisema pulmonar, possui a transferência de gás carbônico reduzida para o exterior. Nessa situação, pode ocorrer

Uma
pessoa ao temperar sua salada utilizou apenas uma pitada de sal (cloreto de
sódio) e aproximadamente 3 mL de vinagre (solução aquosa contendo ácido
acético) e 9 mL de água. Considere que o sal não influenciará o pH, que o
vinagre é uma solução 4% (m/v) de ácido acético (CH3COOH), sendo esta a
substância responsável pelo caráter ácido desta solução.
(Dados:
densidade do vinagre = 1 ,05 g/mL; Ka=1,75x10-5)
A expressão de equilíbrio do ácido acético é:

Uma
das consequências do aumento do dióxido de carbono na atmosfera é a
acidificação dos oceanos. Naturalmente, tem-se o equilíbrio químico entre o
dióxido de carbono da atmosfera e o dissolvido nos oceanos. Com o aumento de
dióxido de carbono nas águas oceânicas esse equilíbrio é perturbado, e, logo,
organismos vivos constituídos, principalmente, de carbonato de cálcio, são
prejudicados.
Sobre o aumento da acidez nos oceanos e as suas
consequências, analise as proposições.
I. A
acidificação dos oceanos ocorre devido à reação química entre o gás carbônico
dissolvido e a água, resultando na formação do ácido carbônico cuja fórmula
química é HCO3.
II. Os
íons carbonatos provenientes do equilíbrio do carbonato de cálcio reagem com os
íons H+ gerados pelo ácido carbônico,
a fim de compensar o excesso de acidez gerado no oceano.
III. O
caráter mais ácido dos oceanos favorece a descalcificação dos exoesqueletos dos
corais, assim como dificulta a formação de novas estruturas de carbonato de
cálcio.
Assinale
a alternativa correta.
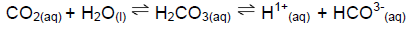 Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o
Esses equilíbrios químicos mantêm o pH do sangue em aproximadamente 7,4. A razão normal entre o 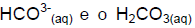 é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao
organismo, devido às alterações metabólicas, podendo causar a morte.
é de 20:1, respectivamente. Se ela for alterada, pode causar danos ao
organismo, devido às alterações metabólicas, podendo causar a morte. Levando em conta as informações acima, é correto afirmar que
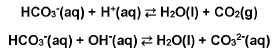
Ao adicionar carbonato de sódio na água de uma piscina, que está em condições consideradas adequadas para o banho, ocorrerá:
Os fertilizantes utilizados na reposição dos elementos químicos indispensáveis para o desenvolvimento dos vegetais são constituídos por sais inorgânicos, como o nitrato de potássio, KNO3(s), hidrogeno-fosfato de cálcio, CaHPO4(s), cloreto de amônio, NH4Cl(s), dentre outros. Os nutrientes são absorvidos pelas raízes das plantas sob a forma de íons, obtidos pela dissolução dos sais na água retida no solo, e dependem do pH do ambiente.
Com base nas informações associadas às estruturas e às propriedades dos sais inorgânicos, é correto afirmar
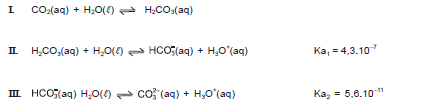
Considerando-se as informações do texto, o sistema em equilibrio, a acidificação dos oceanos e alguns impactos causados às baleias e aos ecossistemas marinhos, associados aos conhecimentos das Ciências da Natureza, é correto afirmar:
HCN (aq) ⇔ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro: grau de ionização
Símbolo: α
Parâmetro: constante de equilíbrio
Símbolo: Ka
Parâmetro: potencial hidrogeniônico
Símbolo: pH
Parâmetro: concentração de HCN
Símbolo: [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização.
O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
HCN (aq)⇌ H+ (aq) + CN– (aq)
Um experimento sobre esse equilíbrio químico, realizado a temperatura constante, analisou quatro parâmetros, apresentados na tabela:
Parâmetro Símbolo grau de ionização α constante de equilíbrio Ka potencial hidrogeniônico pH concentração de HCN [HCN]
Ao ser estabelecido o equilíbrio químico da ionização, foi adicionada certa quantidade de NaCN(s). Após a dissolução e dissociação completa desse composto, houve deslocamento do equilíbrio de ionização. O parâmetro que sofreu redução, após a adição do composto, é representado pelo seguinte símbolo:
Um laboratório realiza a análise de células utilizando uma solução fisiológica salina com pH neutro. O laboratório dispõe de apenas quatro substâncias que poderiam ser usadas no preparo dessa solução: HCl, NaCl, NaOH e NaHCO3 .
Dentre elas, a que deve ser escolhida para uso na análise está indicada em:
As antocianinas existem em plantas superiores e são responsáveis pelas tonalidades vermelhas e azuis das flores e frutos. Esses corantes naturais apresentam estruturas diferentes conforme o pH do meio, o que resulta em cores diferentes.
O cátion flavílio, por exemplo, é uma antocianina que apresenta cor vermelha e é estável em pH ≈ 1. Se juntarmos uma solução dessa antocianina a uma base, de modo a ter pH por volta de 5, veremos, durante a mistura, uma bonita cor azul, que não é estável e logo desaparece.
Verificou-se que a adição de base a uma solução do cátion flavílio com pH ≈ 1 dá origem a uma cinética com 3 etapas de tempos muito diferentes. A primeira etapa consiste na observação da cor azul, que ocorre durante o tempo de mistura da base. A seguir, na escala de minutos, ocorre outra reação, correspondendo ao desaparecimento da cor azul e, finalmente, uma terceira que, em horas, dá origem a pequenas variações no espectro de absorção, principalmente na zona do ultravioleta.
(Paulo J. F. Cameira dos Santos et al. “Sobre a cor dos vinhos:
o estudo das antocianinas e compostos análogos não parou
nos anos 80 do século passado”. www.iniav.pt, 2018. Adaptado.)
A variação de pH de ≈1 para ≈5 significa que a concentração de íons H+ (aq) na solução ________ , aproximadamente, _______vezes. Entre as etapas cinéticas citadas no texto, a que deve ter maior energia de ativação e,
portanto, ser a etapa determinante da rapidez do processo
como um todo é a _________.
As lacunas do texto são preenchidas, respectivamente, por:
Analise as afirmativas.
I - A elevação do pH de uma piscina favorece a dissolução dos floculantes presentes na água.
II - O pH de um suco de tomate, em média, deverá ser igual a 4,2 – aproximadamente 1000 vezes mais ácido que a água de uma piscina em boas condições.
III - No tratamento de uma piscina é comum a utilização de barrilha (Na2CO3 – carbonato de sódio) para a elevação do pH, pois produz uma solução de caráter alcalino.
IV - No tratamento de microrganismos em piscinas, é comum a utilização de sais de hipoclorito, que fornecem à água o íon Cl-1(aq).
São verdadeiras, apenas

