Questões de Vestibular
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 328 questões
Um estudante de Engenharia Química pipeta 50mL de solução aquosa 0,02mol/L de ácido clorídrico e transfere para um balão volumétrico de 1000mL, ajustando-se para esse volume a solução final, usando água pura.
O pH da solução final é igual a
Esse valor de pH é Dado: log 2 = 0,3
A ÁGUA
A água é o melhor solvente que existe. O pH é determinado por meio de uma escala universal graduada de 0 a 14, a 25 °C, sendo 7 o ponto correspondente à neutralidade. Portanto, quando a água tem um pH inferior a 7, diz-se que a água é ácida; se é igual a 7, diz-se que é neutra e, se é superior a 7, diz-se que a água é alcalina. É importante saber que, em condições de saúde, o líquido intracelular e o extracelular apresentam um pH que oscila entre 7,35 e 7,45, ou seja, levemente alcalino. Nosso organismo tende à alcalinidade, então a água saudável deve ser alcalina.
Disponível em:<http://phsaude.blogspot.com.br/2014/07/o-que-e-ph.html> . Acesso em: 7 de agosto de 2016.
Qual das substâncias a seguir se deve adicionar à água que será consumida por um indivíduo, para torná-la saudável?
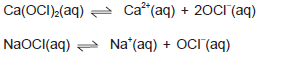
O tratamento de piscinas inclui a cloração da água que pode ser feita com a utilização de Ca(OCl)2(s), NaOCl(aq), e mesmo Cl2(g).Com base nessas informações e nos conhecimentos sobre reações químicas e equilíbrio iônico em soluções aquosas, pode-se afirmar:

Em determinadas cidades, os Centros de Recursos Ambientais orientam para que não sejam lançados no meio ambiente efluentes líquidos com pH inferior a 5 ou superior a 9.A tabela apresenta as concentrações de H3O+(aq) ou OH−(aq)nos efluentes industriais X, Y e Z. Com base nessas informações e nos conhecimentos sobre equilíbrio químico, estudo dos líquidos e química e ambiente, pode-se afirmar, em relação a esses efluentes, que
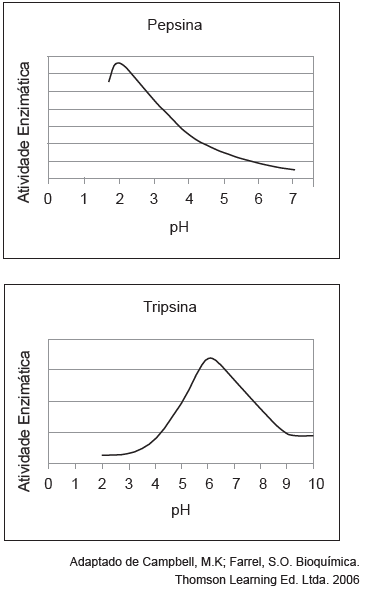
Com base na análise dos gráficos, podemos concluir que as atividades das enzimas pepsina e tripsina serão máximas quando as concentrações de íons hidrônio (H+) no meio, em mol L−1, forem, aproximadamente e respectivamente,
O uso crescente de combustíveis fósseis é responsável pelo aumento dos níveis de CO2 na atmosfera,o que gera graves riscos ambientais. Um dos efeitosdo acúmulo de CO2 na atmosfera é que, em contatocom a água do mar, esse gás dissolve-se e reage deacordo com a equação abaixo:
CO2 + H2O → H+ + HCO3 −
Uma das consequências disso é que o pH da água domar torna-se mais ________, ameaçando espéciesmarinhas que dependem de estruturas calcárias parasua sobrevivência, como ________ e ________. Emtais condições de pH, as partes calcárias tendem a sedissolver. Com o desaparecimento dos corais, centenas de espécies que dependem deles serão extintas.
Na tabela abaixo estão descritos alguns dados de três ácidos inorgânicos de Bronsted-Lowry:
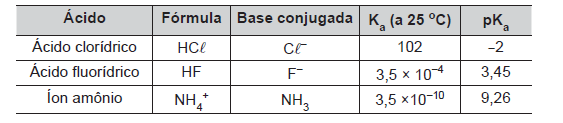
Em relação aos três ácidos acima e suas bases conjugadas, assinale a afirmação correta:
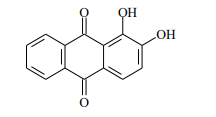
Dentre as soluções incolores (preparadas com água pura, ou seja, com pH neutro), qual poderia promover o aparecimento da coloração violeta no indicador de pH alizarina?
Sob temperatura de 25ºC foram misturados 500mL de uma solução de hidróxido de sódio 0,1 mol/L com 500mL de uma solução de ácido clorídrico 0,05 mol/L. Assim, analise as afirmações a seguir. Dados: log5 = 0,7
I A mistura terá um pH = 12,4.
II Na mistura terá [OH- ] = 2,5.10-3 mol/L.
III Na mistura terá uma [Na+ ] = 0,05 mol/L.
IV Na mistura terá uma [Cl- ] = 0,05 mol/L.
Está(ão) correta(s) apenas:
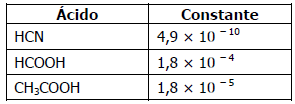
A respeito das soluções aquosas dos sais sódicos dos ácidos fracos, sob condições de concentrações idênticas, pode-se afirmar que a ordem crescente de pH é
I - É um ácido forte, pois ataca até o vidro.
II - Tem, quando em solução aquosa, no equilíbrio, concentração de íons fluoreto muito inferior à de HF.
III- Forma fluoreto de sódio insolúvel, quando reage com hidróxido de sódio.
Quais estão corretas?
A solução A foi preparada pela diluição de 100,0 mL de solução de HCl (1,0 mol L-1 ), com água destilada, até completar 1,0 L. Já a solução B foi preparada com 1,0 mL da solução A e misturada com 90,0 mL de solução de NaOH (0,0010 mol L-1 ), para, em seguida, ser diluída para 1,0 L com água destilada.
Na temperatura de 25 °C, em quantas unidades de pH a solução A é MENOR do que a solução B?