Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 991 questões
O medicamento utilizado para destacar órgãos em exames radiológicos pode ter causado a morte de pelo menos 21 pessoas no país. Sua matéria-prima é o sulfato de bário. Análise preliminar da Fiocruz (Fundação Oswaldo Cruz) apontou a presença de carbonato de bário em um lote do produto distribuído por determinado laboratório. O carbonato de bário é utilizado em venenos para rato. Pacientes tomam sulfato de bário para que os órgãos de seu sistema digestório fiquem visíveis nas radiografias. É o chamado contraste.
Considere que o Ks do sulfato de bário é 1 x 10-10 .
O sulfato de bário é administrado na forma de uma suspensão.
Disponível em: <http://www1.folha.uol.com.br/folha/cotidiano/ult95u76538.shtml> Acesso em: 10 ago. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
O bário normalmente forma cloreto de fórmula BaCl.
Dados: MM(Na2 CO3 ) = 106g/mol
Na2 CO3 + HCl⬄ NaCl + H2 CO3
Para essas espécies químicas, constata-se que

Frasco Identificação 1 Solução de HCl 0,1 mol/L 2 Solução de Glicose 0,5 mol/L 3 Solução de MgCl2 0,1 mol/L 4 Solução de KCl 0,2 mol/L 5 Solução de CaCl2 0,2 mol/L
Analisando a descrição dos frascos, o aluno chegou à conclusão de que a ordem crescente de temperatura de congelamento das soluções é:

Uma
das consequências do aumento do dióxido de carbono na atmosfera é a
acidificação dos oceanos. Naturalmente, tem-se o equilíbrio químico entre o
dióxido de carbono da atmosfera e o dissolvido nos oceanos. Com o aumento de
dióxido de carbono nas águas oceânicas esse equilíbrio é perturbado, e, logo,
organismos vivos constituídos, principalmente, de carbonato de cálcio, são
prejudicados.
Sobre o aumento da acidez nos oceanos e as suas
consequências, analise as proposições.
I. A
acidificação dos oceanos ocorre devido à reação química entre o gás carbônico
dissolvido e a água, resultando na formação do ácido carbônico cuja fórmula
química é HCO3.
II. Os
íons carbonatos provenientes do equilíbrio do carbonato de cálcio reagem com os
íons H+ gerados pelo ácido carbônico,
a fim de compensar o excesso de acidez gerado no oceano.
III. O
caráter mais ácido dos oceanos favorece a descalcificação dos exoesqueletos dos
corais, assim como dificulta a formação de novas estruturas de carbonato de
cálcio.
Assinale
a alternativa correta.
 A correspondência correta entre os compostos e a possibilidade de aplicação, de cima para baixo, é
A correspondência correta entre os compostos e a possibilidade de aplicação, de cima para baixo, é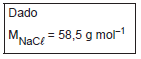
Instrução: Leia atentamente o texto abaixo para responder a questão.


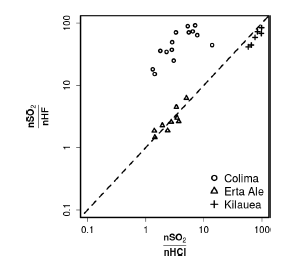
De acordo com a figura, em relação às quantidades de gases dissolvidos no magma, é correto afirmar que as concentrações de SO2 são maiores que as de HF e de HCl
Fake News ou não? Hoje em dia, a disponibilidade de informações é muito grande, mas precisamos saber interpretá-las corretamente. Um artigo na internet tem o seguinte título: “Glutamato monossódico, o sabor que mata!”. Em determinado ponto do texto, afirma-se:
“Só para você ter ideia dos riscos, organizações internacionais de saúde indicam que a ingestão diária de sódio para cada pessoa seja de 2,3 gramas. O glutamato é composto por 21% de sódio e, com certeza, não será o único tempero a ser acrescentado ao seu almoço ou jantar.
Além disso, o realçador (glutamato) só conta um terço do nutriente que é encontrado no sal de cozinha.”
Dados de massas molares em g·mol-1 : sódio = 23, cloreto = 35,5, glutamato monossódico = 169.
Para tornar a argumentação do artigo mais consistente do ponto de vista químico, você sugeriria a seguinte reescrita dos trechos destacados: