Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 980 questões
O NOx é o principal causador da chuva ácida. A seguir temos três reações que produzem NOx:
I - N2+ O2 → 2NO
II - 2NO + O2 → 2NO2
III - 2NO2+ O2 → 2NO3
ASSINALE a alternativa que contém a informação correta sobre o número de oxidação do Nitrogênio em cada reação.
Analise este rótulo de uma embalagem comercial de óleo de soja, um dos alimentos mais consumidos pela população brasileira.
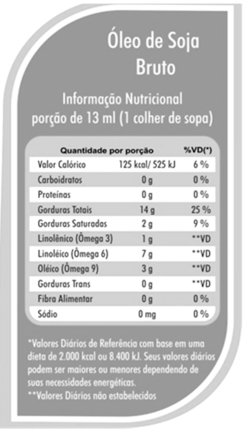
Fonte:: http://www.oleosdobrasil.com.br/ - Acesso em 29 de Fevereiro de 2016.
Ao analisar esse rótulo, é CORRETO afirmar que óleo de soja é
20g NaOH em 1L + 50g NaOH em 1L → 70g NaOH em 2L
Logo, para a solução final, temos:


Considere as reações:
I. CN– + H2O ⇌ HCN + OH– II. CN– + NH3 ⇌HCN + NH– 2 III. H2O + NH3 ⇌ NH4+ + OH–
De acordo com essa teoria ácido-base, o cianeto, em I e II, e a amônia, em II e III, são classificados, respectiva e corretamente, como:
O MgCO3, chamado popularmente de pó de magnésio, é usado pelos atletas da ginástica artística, sendo aplicado nas mãos antes de iniciar a atividade para eliminar o suor, dando maior firmeza. Sobre esse composto, foram feitas as seguintes afirmações:
I – pertence à função sal.
II – é formado por 3 elementos e 6 átomos.
III – é uma substância simples.
IV – é um composto iônico.
V – o metal, presente em sua fórmula, pertence à família dos metais alcalinos.
Assinale a alternativa CORRETA.
Um estudante foi ao laboratório e realizou uma série de experimentos para identificar um determinado composto químico. As observações sobre esse composto estão descritas abaixo:
Observação 1 - Possuía propriedades corrosivas.
Observação 2 - Possuía alta solubilidade em água.
Observação 3 - O papel de tornassol ficou vermelho em contato com ele.
Observação 4 - Apresentou condução de correte elétrica quando dissolvido em água.
Baseado nas observações feitas pelo estudante, pode-se afirmar que o composto analisado é:
Determinada água mineral apresenta o seguinte rótulo:

(Disponivel em: https://cdlcenter.com/agua-mineral-viva-20lt-comgarrafao/produto/19198-0-0. Acesso em 28 de agosto de 2016)
Analisando o rótulo da água apresentado, é INCORRETO
afirmar:

 I. Ao beber 960 mL de suco de acerola natural, o atleta
ingeriu menos calorias que se tivesse tomado 240 mL de
suco de maçã natural.
II. Ao beber 960 mL de suco de acerola natural, o atleta
ingeriu mais calorias que se tivesse tomado 240 mL de suco
de maçã natural.
III. Ao tomar 500 ml de água de coco, o atleta ingeriu
aproximadamente 129 calorias.
IV. Ao beber 4 copos de suco de tomate natural, o atleta ingeriu
menos calorias que se tivesse tomado 1 copo de suco
manga natural.
Estão corretas:
I. Ao beber 960 mL de suco de acerola natural, o atleta
ingeriu menos calorias que se tivesse tomado 240 mL de
suco de maçã natural.
II. Ao beber 960 mL de suco de acerola natural, o atleta
ingeriu mais calorias que se tivesse tomado 240 mL de suco
de maçã natural.
III. Ao tomar 500 ml de água de coco, o atleta ingeriu
aproximadamente 129 calorias.
IV. Ao beber 4 copos de suco de tomate natural, o atleta ingeriu
menos calorias que se tivesse tomado 1 copo de suco
manga natural.
Estão corretas: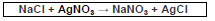
Analise a reação, e assinale a alternativa correta
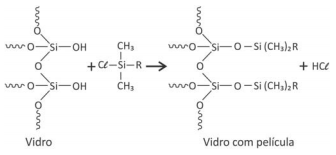
Das alternativas apresentadas, a que representa o melhor material a ser aplicado ao vidro, de forma a evitar o acúmulo de água,
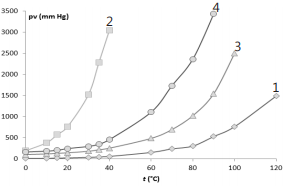
Assinale a alternativa CORRETA:
I. Generalizando, todos os sais de fosfatos (PO4 3- ) são insolúveis; II. O di-hidrogenofosfato de sódio, NaH2 PO4 , é insolúvel; III. O di-hidrogenofosfato de amônio, (NH4 ) 3 PO4 , é solúvel; IV. Generalizando, todos os sais de hidróxidos (OH- ) são insolúveis; V. O hidróxido de sódio, NaOH, é solúvel.
Destas afirmações, estão CORRETAS:
Leia o texto para responder à questão.
“Houston, we have a problem”. Ao enviar essa mensagem, em 13 de abril de 1970, o comandante da missão espacial Apollo 13 sabia que sua vida e as dos seus dois companheiros estavam por um fio. Um dos tanques de oxigênio (O2 ) tinha acabado de explodir. Apesar do perigo iminente dos astronautas ficarem sem O2 para respirar, a principal preocupação da NASA era evitar que a atmosfera da espaçonave ficasse saturada do gás carbônico (CO2), exalado pela própria equipe. Isso causaria diminuição do pH do sangue da tripulação (acidemia sanguínea), já que o CO2 é um óxido ácido e, em água, ele forma ácido carbônico: CO2 (g) + H2O (l) g → H2CO3 (aq).
A acidemia sanguínea deve ser evitada a qualquer custo. Inicialmente, ela leva a pessoa a ficar desorientada e a desmaiar, podendo evoluir até o coma ou mesmo a morte.
Normalmente, a presença de CO2 na atmosfera da nave não é problema, pois existem recipientes, adaptados à ventilação com hidróxido de lítio (LiOH), uma base capaz de absorver esse gás. Nada quimicamente mais sensato: remover um óxido ácido lançando mão de uma base, através de uma reação de neutralização.
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
1. NH4 + ( ) É um óxido, nesta classe de compostos o elemento oxigênio é o elemento mais eletronegativo. 2. CO2 ( ) É uma base e, segundo Brønstead-Lowry, pode receber um ou mais prótons. 3. NH3 ( ) É um ácido, segundo Brønstead-Lowry, cuja definição de ácido é qualquer espécie química que exiba tendência a doar prótons (íons H+ ). 4. KMnO4 ( ) É um sal, e essa classe de compostos é um dos produtos da reação entre um ácido e uma base.
Assinale a alternativa que contém a sequência correta, de cima para baixo.

