Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 971 questões
Frente ao exposto, pode-se inferir que:
CLASSIFICAÇÃO: Água mineral Fluoretada e Vanádica CARACTERÍSTICAS FÍSICO-QUÍMICA
pH a 25 °C ........................................................................................................... 6,79 Temperatura da água na fonte ....................................................................... 21,3 °C Condutividade elétrica a 25 °C .................................................................. 296 uS/cm Resíduo de evaporação a 180 °C, calculado ........................................... 245,24 mg/L Radioatividade na fonte a 20 °C e 760 mmHg ........................................ 0,97 maches
COMPOSIÇÃO QUÍMICA (mg/L)
Bicarbonato ..................................................................................................... 158,79 Cálcio ............................................................................................................... 31,426 Sódio ................................................................................................................ 15,583 Magnésio .......................................................................................................... 13,193 Cloreto ................................................................................................................. 8,43 Potássio ............................................................................................................. 0,438 Fluoreto ............................................................................................................... 0,14 Estrôncio ............................................................................................................ 0,111 Vanádio .............................................................................................................. 0,026
Considerando as informações apresentadas, qual é a concentração em mmol/L do único ânion oxigenado apresentado na tabela?
Um volume de 100 mL de uma solução aquosa de NaC 0,100 mol L-1 foi misturado com 50 mL de solução de Pb(NO3)2 0,050 mol L-1. A alternativa que indica mais proximamente a massa, em g, de PbCℓ2(s) produzida, assumindo reação com 100% de rendimento é a
Dado
M PbCℓ2
= 278 g mol-1
As reações químicas abaixo ocorrem quando o óxido de magnésio é adicionado à água.
I - MgO(s) + H2 O(ℓ) → Mg(OH)2 (aq)
II - Mg(OH)2(aq) ⇌ Mg(OH)2 (s)
III - Mg(OH)2(s) ⇌ Mg2+ (aq) + 2 OH- (aq)
Sobre essas reações e seus reagentes e produtos, pode-se concluir que
Diferentes métodos são utilizados por profissionais da área de Ciência Forense para determinar a quanto tempo o indivíduo veio a óbito. Pesquisadores brasileiros reportaram que existe uma relação linear entre a concentração de Fe2+ no corpo vítreo do olho com o intervalo pós-morte. Este método é baseado em uma reação de Fe2+ com orto-fenantrolina como agente cromogênico realizada em um dispositivo de papel, cujo produto da reação apresenta coloração alaranjada. Desta forma, quanto maior o tempo de intervalo pós-morte maior a intensidade de coloração do produto.
(Adaptado de: GARCIA, P.T.; GABRIEL, E.F.M.; PESSÔA, G.S.; SANTOS JUNIOR, J.C.; MOLLO FILHO, P. C.; GUIDUGLI, R.B.F.; HÖEHR, N.F.; ARRUDA, M.A.Z.; COLTRO, W.K.T, Analytica Chimica Acta, v. 974, n.29, p.69-74, 2017).
A equação química da reação de Fe2+ com orto-fenantrolina é apresentada na figura seguir.
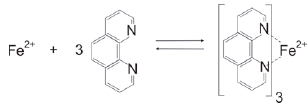
Considerando os conceitos, as definições de ácido e base e a reação química apresentada, assinale a alternativa correta.
O sulfeto de níquel (II), NiS, ocorre na natureza como um mineral relativamente raro, a millerita. Uma de suas ocorrências é em meteoritos. Para se determinar a quantia de NiS em uma amostra do mineral, ela é tratada com ácido nítrico para liberar o níquel.
NiS(s) + 4HNO3(aq) → Ni(NO3)2(aq) + S(s) + 2NO2(g) + 2H2O(l)
A solução aquosa de Ni(NO3)2 é então tratada com o composto orgânico dimetilglioxima (C4H8N2O2 – DMG) para formar o sólido vermelho Ni(C4 H7N2O2 )2(s) de acordo com a reação:
Ni(NO3 )2(aq) + 2 C4 H8 N2 O2(aq) → Ni(C4 H7 N2 O2 ) 2(s) + 2 HNO3(aq
Se uma amostra de 0.468 g contendo millerita
produz 0.206 g do sólido vermelho Ni(C4
H7
N2
O2
)2(s) , a
porcentagem de NiS na amostra é:
Um volume de 16.42 mL de uma solução de permanganato de potássio 0.1327 M é necessário para oxidar 20.00 mL de uma solução de FeSO4 em meio ácido.
Considere que a equação não balanceada representativa da reação é:
Fe2+ + MnO4 − + H+ → Mn2+ + Fe3+ + H2O
A concentração da solução do sal de ferro será
aproximadamente:
Um dos parâmetros que determina a qualidade do azeite de oliva é sua acidez, normalmente expressa na embalagem na forma de porcentagem, e que pode ser associada diretamente ao teor de ácido oleico em sua composição.
Uma amostra de 20,00 g de um azeite comercial foi adicionada a 100 mL de uma solução contendo etanol e etoxietano (dietiléter), 1:1 em volume, com o indicador fenolftaleína. Sob constante agitação, titulou-se com uma solução etanólica contendo KOH 0,020 mol/L até a ________________ total. Para essa amostra, usaram-se 35,0 mL de base, o que permite concluir que se trata de um azeite tipo ________________.

As palavras que completam corretamente as lacunas são:
Em análises metalúrgicas, emprega-se uma solução denominada nital, obtida pela solubilização do ácido nítrico em etanol.
Um laboratório de análises metalúrgicas dispõe de uma solução aquosa de ácido nítrico com concentração de 60% m/m e densidade de 1,4 kg/L. O volume de 2,0 mL dessa solução é solubilizado em quantidade de etanol suficiente para obter 100,0 mL de solução nital.
Com base nas informações, a concentração de ácido nítrico, em g.L−1 , na solução nital é igual a:
No século XIX, o cientista Svante Arrhenius definiu ácidos como sendo as espécies químicas que, ao se ionizarem em solução aquosa, liberam como cátion apenas o íon H+ . Considere as seguintes substâncias, que apresentam hidrogênio em sua composição: C2H6 , H2SO4 , NaOH, NH4Cl.
Dentre elas, aquela classificada como ácido, segundo a definição de Arrhenius, é:
O cloreto de sódio, principal composto obtido no processo de evaporação da água do mar, apresenta a fórmula química NaCl.
Esse composto pertence à seguinte função química:

